
【题目】由下列实验及现象推出的相应结论正确的是 ( )
选项 | 实验 | 现象 | 结论 |
A | 某溶液中滴加K3 [Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中有Fe2+,Fe3+ |
B | 向C6H5ONa溶液中通入CO2 | 溶液变浑浊 | 酸性:H2CO3>C6H5OH |
C | 向K2Cr2O7的酸性溶液中滴加乙醇 | 橙色溶液变为绿色 | 乙醇发生消去反应生成乙烯 |
D |
|
| 原溶液中有SO42- |
A.AB.BC.CD.D
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.12C、13C和14C互为同位素,他们的放射性可用于考古断代,可测定生物体死亡的年代
B.合成纤维是利用自然界的纤维材料通过化学合成方法得到的
C.研制出性能优良的催化剂可以使反应的温度降低,从而起到很好的节能效果
D.碰撞理论和过度态理论是常用的化学反应速率理论,其中过渡态理论可解释温度、浓度等对化学反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3。试回答下列问题:
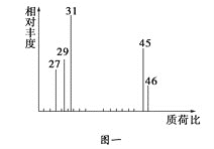
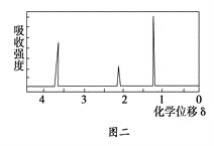
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)A的分子式是_______________________________________。
(4)A的结构简式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.0mL 0.10 mol·L-1某二元酸H2R溶液中滴加入同物质的量浓度的NaOH溶液,测得溶液的pH随NaOH溶液体积的变化如右图所示。下列说法中正确的是
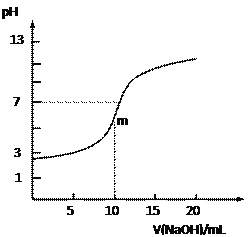
A. 无法判断H2R是强酸还是弱酸
B. 曲线上m点时溶液中c(Na+)>c(HR-) >c(R2-)>c(H+)
C. HR-的电离能力大于水解能力
D. 溶液中c(Na+)+c(H+)=c(HR-)+c(R2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论都正确的是 ( )
选项 | 实验操作 | 现象 | 结论 |
A | 将石蜡油分解产生的气体通入酸性高锰酸钾溶液中 | 紫红色溶液变无色 | 石蜡油裂解一定产生了乙烯 |
B | 用水浸过的棉花包裹铁粉放入试管并加热,将气体通入四氯化碳溶液中 | 四氯化碳中产生气泡 | 铁粉与水蒸气在高温下一定产生了氢气 |
C | 向重铬酸钾溶液中滴加乙醇 | 橙红色溶液变绿色 | 乙醇表现出还原性 |
D | 向2ml0.1mol/L的AgNO3溶液中先滴加2滴0.1mol/L NaCl溶液,再滴入 | 先产生白色沉淀,后沉淀变成黄色 | 相同温度下,AgCl在水中的溶解度大于AgI的溶解度 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)配制250mL 0.2000 mol/L盐酸标准溶液,所需玻璃仪器有______、______量筒、烧杯、玻璃棒。
(2)盛装0.2000 mol/L盐酸标准液应该用______式滴定管。(填“酸”或“碱”)
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_________,直到加入一滴盐酸后,溶液由_________,即到终点。
(4)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作
正确的操作顺序为:_________。
(5)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为__________mol/L。
(6)若滴定时锥形瓶未干燥,则测定结果____________;若滴定前平视读数,滴定终点时仰视读数,则所测碱的浓度值_________。(填“无影响”、“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①0.2mol/LNaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X—)。则:
(1)①中由水电离出的c(OH)-___②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在___种粒子。且:c(HX)___c(X-)。(填“>”、“=”或“<”,下同)c(HX)+c(X-)___0.1mol/L(忽略体积变化)
请根据电荷守恒写出一个用离子浓度表示的等式:___。
(3)上述混合液显___性(填“酸”、“碱”或“中”),其原因用离子方程式表示___。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)___25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述中,不正确的是( )
A. 淀粉![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B. 纤维素![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C. 油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D. 蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com