
| A. | 具有较高能量的分子是活化分子 | |
| B. | 活化分子间的碰撞一定是有效碰撞 | |
| C. | 不同化学反应需要的活化能有可能差别很大 | |
| D. | 反应的活化能大小不会影响化学反应速率 |
分析 活化分子的能量比普通分子高,不同的化学反应需要的活化能差别很大,有些分子可能能量很高了,但不一定是该反应的活化分子,物质发生化学反应,必须分子间发生有效碰撞,有效碰撞的条件:①活化分子,②有合适的取向,据此分析.
解答 解:A、不同反应活化分子的能量差距很大,具有较高能量的分子未必是活化分子,故A错误;
B、活化分子碰撞必须有合适的取向才是有效碰撞,故B错误;
C、不同反应活化分子的能量差距很大,所以不同的化学反应需要的活化能差别很大,故C正确;
D、反应的活化能大小与反应速率无关,活化分子百分数决定反应速率,高温下,即使反应物的活化能高,但活化分子百分数大,反应速率照样很快,故D错误;
故选C.
点评 本题主要考查了有效碰撞、化学反应的本质等,难度中等,注意有效碰撞的条件:①活化分子,②有合适的取向.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
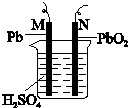 已知铅蓄电池的反应原理是:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)△H<0图为铅蓄电池的示意图.下列说法正确的是( )
已知铅蓄电池的反应原理是:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)△H<0图为铅蓄电池的示意图.下列说法正确的是( )| A. | 充电时,阳极的电极反应式为:PbSO4+2e-═Pb+SO42- | |
| B. | 充电时,若N连接电源正极,则该极生成PbO2 | |
| C. | 放电时,c(H2SO4)不变,两极的质量增加 | |
| D. | 放电时,N为负极,其电极反应式为:PbO2+SO42-+4H++2e-═PbSO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 品 名 | 火腿 |
| 配 料 | ①精选瘦肉 ②食盐 ③VC ④亚硝酸钠等 |
| 保质期 | 0℃~4℃30天 |
| 生产日期 | 见包装封口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | HS-+H2O?S2-+H3O+ | ||
| C. | HCO3-+OH-?CO32-+H2O | D. | CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
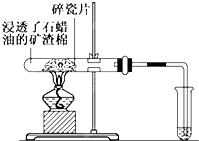 石蜡油(主要是含17个碳原子以上液态烷烃混合物)分解实验按如图所进行:
石蜡油(主要是含17个碳原子以上液态烷烃混合物)分解实验按如图所进行:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③④ | C. | ②④⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
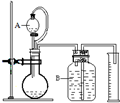 工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质.为测定碱中各成分的百分含量可采用滴定法、气体法等.
工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质.为测定碱中各成分的百分含量可采用滴定法、气体法等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com