

分析 工业制硝酸:N2+3H2$?_{高温高压}^{催化剂}$2NH3;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H20、2NO+O2=2NO2、3NO2+H2O═2HNO3+NO.
(1)反应④是二氧化氮和水反应生成硝酸和一氧化氮;一氧化氮不溶于水,易被空气中的氧气氧化,实验室收集NO应用排水法;
(2)a.氨液化后挥发带走能量,所以可用作制冷剂;
b.铵态氮肥溶解后铵根离子水解显酸性;
c.依据硝酸的性质和应用分析;
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反,随反应进行硝酸变稀后生成一氧化氮;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)氨气在微生物的作用下与氧气反应生成HNO2,依据原子守恒配平书写;
(5)氨水显碱性,二氧化碳是酸性气体,保证原料气的充分利用,要考虑通气体的先后顺序.
解答 解:(1)反应④是二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式3NO2+H2O=2HNO3+NO;一氧化氮不溶于水,易被空气中的氧气氧化选择收集方法,实验室收集NO的方法是排水法;
故答案为:3NO2+H2O=2HNO3+NO;排水法;
(2)a.液氨挥发过程中吸收能量,可用作制冷剂,故a正确;
b.铵态氮肥溶解后铵根离子水解显酸性,一般不能与碱性化肥共同使用,故b正确;
c.硝酸可用于制化肥、农药、炸药、染料、盐类等,故c正确;
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应,随反应进行溶液浓度变稀后反应生成一氧化氮气体,生成NO2 小于1mol,故d错误;
故答案为:d;
(3)①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=-241.8kJ/mol
②N2(g)+3H2(g)=2NH3(g)△H2=-92.0kJ/mol
依据盖斯定律①×3-②得到:2NH3+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=-633.4KJ/mol
则34g氨气物质的量=$\frac{34g}{17g/mol}$=2mol,与氧气反应生成N2(g)与H2O(g)时,△H=-633.4KJ/mol;
故答案为:-633.4;
(4)氨气在微生物的作用下与氧气反应生成HNO2,反应的化学方程式为:2NH3+3O2=2HNO2+2H2O,
故答案为:2NH3+3O2$\frac{\underline{\;微生物\;}}{\;}$2HNO2+2H2O;
(5)先通入足量NH3,再通入CO2的原因是:氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4;
故答案为:NH3极易溶于水且溶于水后呈碱性,增加了CO2的溶解度,生成了大量的CO32-,使CaSO4(s)?Ca2+(aq)+SO42-(aq)溶解平衡向右移动,提高了(NH4)2SO4的产量.
点评 本题考查了氮及其化合物性质的分析应用,热化学方程式书写方法,是一道元素及化合物性质的综合题,题目难度中等,要求学生具备分析和解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 电解后,c(Na2SO4)不变,且溶液中有晶体析出 | |
| B. | 电解池的阳极反应式为:4OH--4e-═2H2O+O2↑ | |
| C. | 蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 | |
| D. | 蓄电池中每生成2molH2O,电解池中就消耗1molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.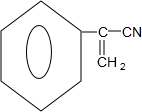 ,E中含氧官能团的名称为羧基.
,E中含氧官能团的名称为羧基. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;元素e的电子排布式为1s22s22p63s23p5,c的离子结构示意图为
;元素e的电子排布式为1s22s22p63s23p5,c的离子结构示意图为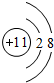
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| B. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++H++OH-+SO42-=BaSO4↓+H2O | |
| C. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO3- | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实 验 操 作 | 答案 | 实验现象 |
| (1)向鸡蛋清中滴加少许浓硝酸,微热 | B | A.紫色褪去 B.变黄色 C.出现蓝色 D.溶液分层,下层呈紫红色 |
| (2)将乙烯通入少量酸性KMnO4溶液中 | A | |
| (3)将CCl4滴入盛有碘水的试管中,充分振荡,静止 | D | |
| (4)向土豆片上滴加碘水 | C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com