
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | C(s)+CO2(g)?2CO(g) (正反应为吸热反应) | |
| C. | 2NO2(g)?N2O4(g) (正反应为放热反应) | |
| D. | 3O2(g)?2O3(g) (正反应为吸热反应) |
分析 减小压强或升高温度都能使化学平衡向正反应方向移动,则反应为气体体积增大的反应、且吸热的反应,以此来解答.
解答 解:A.合成氨的反应中气体的物质的量减小,为放热反应,则减小压强或升高温度都能使化学平衡向逆反应方向移动,故A不选;
B.为气体体积增大的反应、且吸热的反应,则减小压强或升高温度都能使化学平衡向正反应方向移动,故B选;
C.为气体体积减小、放热的反应,则减小压强平衡逆向移动,升高温度能使化学平衡向逆反应方向移动,故C不选;
D.为气体体积减小、吸热的反应,则减小压强平衡逆向移动,升高温度能使化学平衡向正反应方向移动,故D不选;
故选B.
点评 本题考查化学平衡的影响因素,为高频考点,把握反应的特点、温度和压强对平衡的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 已烷有5种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,苯与液溴、硝酸作用生成溴苯,硝基苯都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 电石与水反应,将气体直接通入酸性高锰酸钾溶液,检验气体是否为乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
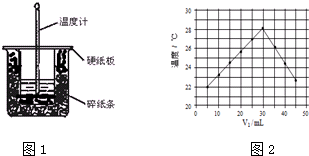
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
| 3 | 25.1 | 25.1 | 25.1 | 33.6 | 8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子交换法淡化海水发生了化学变化 | |
| B. | 海水淡化可为人类提供更多的淡水资源 | |
| C. | 利用太阳能蒸发原理淡化海水属于物理变化 | |
| D. | 将海水中的盐分离出来不能达到海水淡化的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
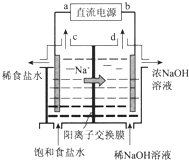 用石墨电极电解饱和NaCl溶液的装置如图所示,请回答:
用石墨电极电解饱和NaCl溶液的装置如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
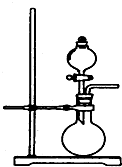 图是实验室制取某些气体的装置.
图是实验室制取某些气体的装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com