
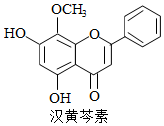
 汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用.下列有关汉黄芩素的叙述正确的是( )
汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用.下列有关汉黄芩素的叙述正确的是( )| A. | 汉黄芩素的分子式为C16H13O5 | |
| B. | 该物质遇FeCl3溶液显色 | |
| C. | 1 mol该物质与溴水反应,最多消耗1mol Br2 | |
| D. | 与足量H2发生加成反应后,该分子中官能团的种类减少1种 |
分析 由结构可知分子式,分子中含酚-OH、碳碳双键、羰基及醚键,结合酚、烯烃等有机物的性质来解答.
解答 解:A.汉黄芩素的分子式为C16H12O5,故A错误;
B.含酚-OH,遇FeCl3溶液显色,故B正确;
C.酚-OH的邻对位与溴水发生取代反应,碳碳双键与溴水发生加成反应,则1 mol该物质与溴水反应,最多消耗2mol Br2,故C错误;
D.与足量H2发生加成反应后,该分子中官能团碳碳双键、羰基均减少,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意H原子数的判断及官能团的判断,题目难度不大.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (1)(2)(5) | C. | (2)(3)(5) | D. | (2)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
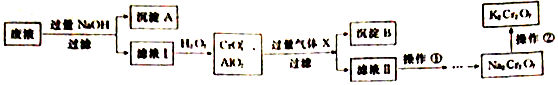
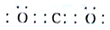 (填电子式)
(填电子式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
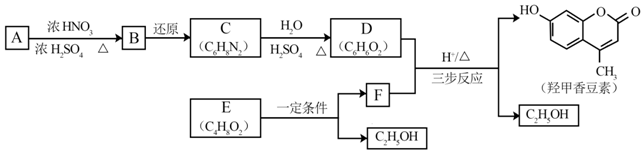
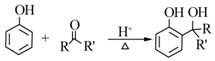
 .B中所含的官能团是硝基.
.B中所含的官能团是硝基.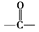 和
和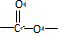 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
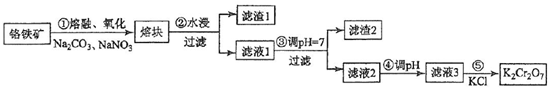
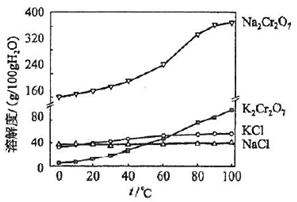
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.
.B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{点燃}^{Cl_{2}}$FeCl2$\stackrel{NaOH(ap)}{→}$Fe(OH)2 | |
| B. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | CaCO3$\stackrel{高温}{→}$CaO$→_{高温}^{SiO_{2}}$CaSiO3 | |
| D. | NH3$→_{催化剂、△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

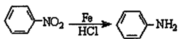 ,-NH2易被强氧化剂氧化
,-NH2易被强氧化剂氧化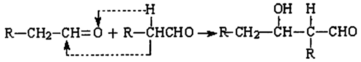
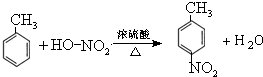 .
.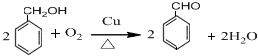 .
.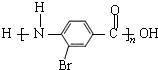 .
.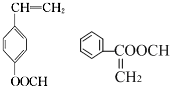 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com