
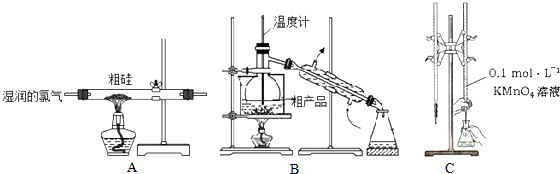
| A. | 用装置A完成SiCl4的制备 | |
| B. | 用装置B进行蒸馏提纯SiCl4 | |
| C. | 用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色 | |
| D. | 配制0.1 mol•L-1KMnO4溶液定容摇匀后,发现液面低于刻度线,加水至刻度线 |
分析 A.SiCl4遇水极易水解;
B.蒸馏时测定馏分的温度;
C.锥形瓶内为亚铁离子的溶液,滴定管为高锰酸钾,则达终点时显高锰酸钾溶液的颜色;
D.定容摇匀后,发现液面低于刻度线,不影响浓度.
解答 解:A.SiCl4遇水极易水解,则不能利用湿润的氯气制备,故A错误;
B.蒸馏时测定馏分的温度,则温度计水银球应在烧瓶支管口处,故B错误;
C.锥形瓶内为亚铁离子的溶液,滴定管为高锰酸钾,则用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色,故C正确;
D.定容摇匀后,发现液面低于刻度线,不影响浓度,若再加水至刻度线,浓度偏低,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备、混合物分离提纯、滴定实验原理等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析和实验装置的作用,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度相等的HA和NaA溶液等体积混合,溶液呈碱性:c(A-)<c(HA) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | pH=3的HCl和pH=11的氨水等体积混合后:c(Cl-)>c(NH4+) | |
| D. | 1.0mol/L Na2CO3溶液:2c(CO32-)+c(HCO3-)+c(OH-)-c(H+)=2.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 化学反应 | 离子方程式 | 评 价 |
| A | 碳酸钙与 醋酸反应 | CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- | 错误,碳酸钙是弱电解 质,不应写成离子形式 |
| B | 苯酚钠溶液中 通入CO2 | 2C6H5O-+CO2+H2O→2C6H5OH+CO32- | 正确 |
| C | NaHCO3的水解 | HCO3-+H2O=CO32-+H3O+ | 错误,水解方程式 误写成电离方程式 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 错误,离子方程式中 Fe2+与Br-的物质的量 之比与化学式不符 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极铝被氧化 | |
| B. | 海水温度升高,电池反应速率可能加快 | |
| C. | 正极制成仿鱼鳃的网状结构的目的是增大正极材料和氧气接触面积 | |
| D. | 正极电极反应式为O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
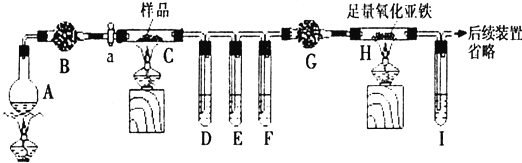
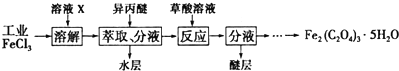
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 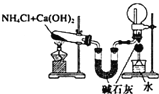 用于制氨气并收集干燥的氨气 | |
| B. | 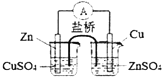 是实现化学能转化为电能的铜锌原电池的原理示意图 | |
| C. | 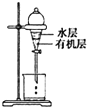 是用CCl4提取碘水中的I2 | |
| D. | 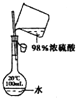 用于配制100mL0.2mo1•L-1的硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
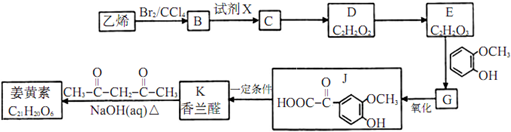

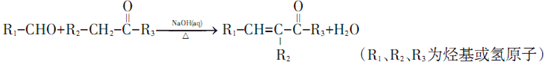
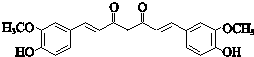 ;
; ;其反应类型是加成反应;
;其反应类型是加成反应;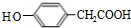 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
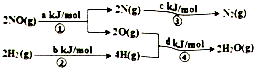 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )| A. | 0.5•(a+b-c-d)kJ/mol | B. | 0.5•(c+a-d-b)kJ/mol | ||
| C. | 0.5•(c+d-a-b)kJ/mol | D. | 0.5•(c+d-a-b)kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com