
配平下列方程式
(1)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
 Ce3++
Ce3++ H2O2+
H2O2+ H2O===
H2O=== Ce(OH)4↓+
Ce(OH)4↓+ ________
________
(2)完成“氧化除铁”步骤中反应的离子方程式:
 Fe(OH)2+
Fe(OH)2+ ClO-+
ClO-+ ________===
________=== Fe(OH)3+
Fe(OH)3+ Cl-
Cl-
(3)配平反应的离子方程式:
 Mn2++
Mn2++ ClO
ClO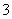 +
+ H2O===
H2O=== MnO2↓+
MnO2↓+ Cl2↑+
Cl2↑+ ________。
________。
(4)配平用钙线脱氧脱磷的化学方程式:
 P+
P+ FeO+
FeO+ CaO
CaO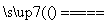
 Ca3(PO4)2+
Ca3(PO4)2+ Fe
Fe
科目:高中化学 来源: 题型:
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述不正确的是
A.b、c两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中C(H+) + C(CH3COOH)= C(OH-)
D.用相同浓度的盐酸分别与等体积的b、c处溶液
反应,消耗盐酸体积Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在0.2mol/L Al2(SO4)3溶液中,逐滴加入1.0mol/L NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:
Al3+ + 3OH-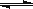 Al(OH)3
Al(OH)3
B.a-b段,溶液pH增大,Al3+浓度不变
C.b-c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如右图所示。下列有关溶液中离子浓度关系叙述正确的是
 A.W点所示的溶液中:
A.W点所示的溶液中:
c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-)
B.pH=4的溶液中:
c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1
C.pH=8的溶液中:
c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-)
D.pH=11的溶液中:
c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A、B、C、D、E是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道 上只有两个电子, C元素的基态原子L层只有2对成对电子,D元素在第三周期元素中电负性最大,E2+的核外电子排布和Ar原子相同。
上只有两个电子, C元素的基态原子L层只有2对成对电子,D元素在第三周期元素中电负性最大,E2+的核外电子排布和Ar原子相同。
请回答下 列问题:
列问题:
(1)分子式为BC2的空间构型为 ;D元素原子的核外电子排布式为  。
。
(2)B第一电离能比C__________(填“大”或“小”);A与B形成的最简单化合物的分子空间构型为___ _____________,其中心原子的杂化为 。
_____________,其中心原子的杂化为 。
(3)A2C所形成的晶体类型为 ;E单质所形成的晶体类型为_______。
(4)若向由A、C组成某种化合物的稀溶液中加入少量二氧化锰,有无色气体生成。则该化合物的分子 式是 ,属于 分子(填:“极性”或“非极性”),该反应的化学方程式是:_________________ __________。
式是 ,属于 分子(填:“极性”或“非极性”),该反应的化学方程式是:_________________ __________。
(5)C跟E可形成离子化合物,其晶胞结构与NaCl的晶胞相似,同为面心立方结构。该离子化合物晶体的密度为ρg·cm-3,NA表示阿伏加德罗常数,则该离子化合物晶胞的体积是 (用含ρ、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl—)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是( )
A.原溶液的浓度为0.1mol/L B.反应后溶液中c(Fe3+)=0.1mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+) D.原溶液中c(Br-)=0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列化学方程式的配平
⑴ KMnO4+ KNO2+囗____── MnSO4+ K2SO4+ KNO3+ H2O
⑵ ClO-+ Fe(OH)3+囗____── Cl-+ FeO42-+ H2O
⑶3Pt+4HNO3+18HCl——3H2PtCl6+4NO↑+囗____
⑷ Na+ H2O── Na++ OH-+ H2↑
⑸ CrO3(红色)+ C2H6O(乙醇)+ H2SO4── Cr2(SO4)3(绿色)+ C2H4O(乙醛)+ H2O
⑹ Cu2S+ HNO3(稀)- Cu(NO3)2+ H2SO4+ NO↑+ H2O
⑺ Na2O2+ CO2── Na2CO3+ O2
⑻ NH4NO3── HNO3+ N2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是________。
(2)写出一个包含上述七种物质的氧化还原反应方程式: 。
(3)上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,溶液颜色无明显变化的是( )
A.KI溶液中滴入淀粉溶液
B.往FeCl2溶液中通入氯气
C.显红色的酚酞溶液中加入过量盐酸
D.往酸性高锰酸钾溶液中通入足量二氧化硫
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com