
| A. | Fe2+、Mg2+、Cl-、NO3-能大量共存于pH=0的溶液中 | |
| B. | 1 L浓度为l mol•L-1的NH4Cl溶液中含有NA个NH4+ | |
| C. | 除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO | |
| D. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,每析出12.8 g S共转移0.8mol电子 |
分析 A.pH=0的溶液,显酸性;
B.NH4+水解;
C.NO与空气中的氧气反应;
D.MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,生成1molS,转移2mol电子.
解答 解:A.pH=0的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.NH4+水解,则1 L浓度为l mol•L-1的NH4Cl溶液中含小于NA个NH4+,故B错误;
C.NO与空气中的氧气反应,则不能利用空气法收集NO,故C错误;
D.MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,生成1molS,转移2mol电子,则每析出12.8 g S共转移电子为$\frac{12.8g}{32g/mol}$×2=0.8mol,故D正确;
故选D.
点评 本题考查较综合,涉及离子共存、盐类水解、氧化还原反应计算等,把握相关反应原理为解答的关键,侧重分析与应用能力的考查,为高考常见的冷拼试题,注重学生思维及时转换的训练,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
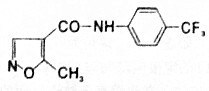
| A. | 分子式为C12H10F3N2O2 | B. | 可以发生水解反应和氧化反应 | ||
| C. | 该化合物易溶于水,难溶于酒精 | D. | 该化合物所有碳原子不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO | B. | NaHCO3 | C. | SiO2 | D. | CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
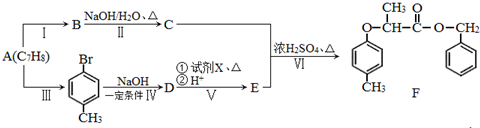

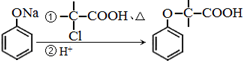
 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$  +NaCl.
+NaCl. .
. 为原料制取
为原料制取 的合成路线图.
的合成路线图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
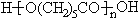 }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下: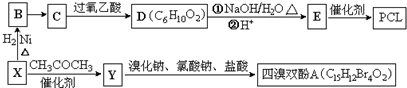
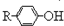 $\stackrel{溴化钠、氯酸钠、盐酸}{→}$
$\stackrel{溴化钠、氯酸钠、盐酸}{→}$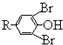
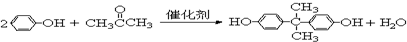 .
.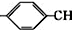 =CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$2CH3
=CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$2CH3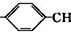 =CHCOOR+2H2O
=CHCOOR+2H2O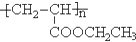 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: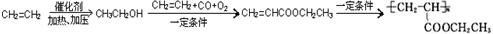 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
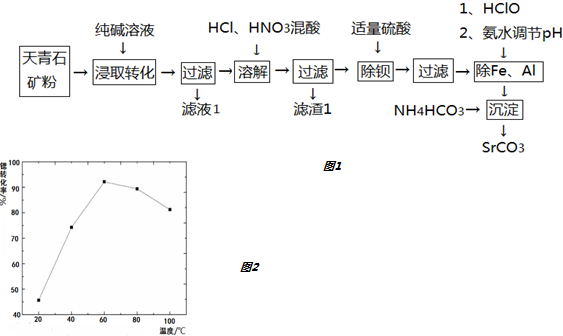
| SrSO4 | BaSO4 | SrCO3 | |
| Ksp | 3.2×10-7 | 1.1×10-10 | 1.6×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
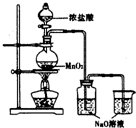 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=3,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
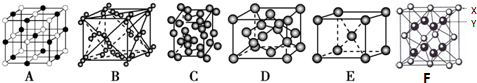
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | ||
| T |
| A. | 根据元素周期律,可以推测存在T3Y4、TZ2和TW4 | |
| B. | X氢化物的沸点一定比Y氢化物的沸点低 | |
| C. | XZ2、XW4与YW3都是非极性分子 | |
| D. | W的氧化物的水化物酸性一定比Z的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com