
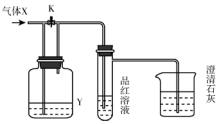
 如图是一套检验气体性质的实验装置.向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y可能的组合是( )
如图是一套检验气体性质的实验装置.向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y可能的组合是( )| A | B | C | D | |
| X | 硫化氢 | 二氧化硫 | 二氧化碳 | 氯化氢 |
| Y | 浓硫酸 | 饱和NaHCO3 | Na2SO3溶液 | 饱和NaHSO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 由装置可知,向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色,则X中含氯气、二氧化硫等,Y中溶液不能吸收氯气、二氧化硫,或X与Y反应生成二氧化硫、氯气等,最后石灰水吸收尾气,以此来解答.
解答 解:A.硫化物与浓硫酸发生氧化还原反应生成二氧化硫,二氧化硫具有漂白性,品红溶液褪色,故A选;
B.二氧化硫与饱和碳酸氢钠反应生成二氧化碳,二氧化碳不能使品红褪色,故B不选;
C.二者不反应,且二氧化碳不能使品红褪色,故C不选;
D.HCl与饱和NaHSO3反应生成二氧化硫,二氧化硫具有漂白性,品红溶液褪色,故D选;
故选AD.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质、发生的反应和现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中的SO42-,加入HCl酸化的Ba(NO3)2溶液,观察有无白色沉淀生成 | |
| B. | 除去NO中混有的少量NO2,将混合气体通入水中,再用排空气法收集NO | |
| C. | 用NaNO3固体与浓硫酸微热制HNO3 | |
| D. | 通入CO2以除去Na2CO3溶液中混有的NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用ClO2处理后的自来水中,ClO2的浓度应在0.10~0.80mg/L之间.用碘量法检测水中C1O2浓度的实验步骤如下:
用ClO2处理后的自来水中,ClO2的浓度应在0.10~0.80mg/L之间.用碘量法检测水中C1O2浓度的实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com