
| A.向澄清石灰水中加入少量小苏打溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
| B.向氨水中通入过量的SO2:NH3?H2O+SO2=NH4++HSO3- |
| C.氢氧化铁与足量氢碘酸反应:Fe(OH)3+3H+=Fe3++3H2O |
| D.大理石溶解在醋酸溶液中:2H++CaCO3=Ca2++CO2 ↑+H2O |
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3 | K1=3×10-3 |
| K2=3×10-11 |
| A、向Na2CO3溶液中滴加少量氯水:CO32-+2Cl2+H2O=2Cl-+2HClO+CO2 |
| B、向NaHCO3溶液中滴加少量氯水:2HCO3-+CI2=CI-+CIO-+2CO2+H2O |
| C、向NaClO溶液中通入少量CO2:CO2+NaClO+H2O=NaHCO3+HClO |
| D、向NaClO溶液通入足量CO2:CO2+2NaClO+H2O=Na2CO3+2HClO |
查看答案和解析>>
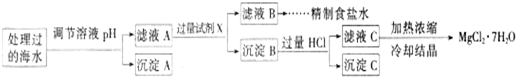
科目:高中化学 来源: 题型:阅读理解
【规格】 每片含琥珀酸亚铁 【适应症】 用于缺铁性贫血症,预防及治疗用 【用量用法】 成人预防量 【贮藏】 避光、密封、在干燥处保存 |
(1)该药品中Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率超过10.00%即不能再服用。
①为了检验某药店出售的“速力菲”是否氧化,实验室应选用的检验试剂为__________(填试剂的名称);
②实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中,其他成分不与KMnO4反应)。请配平下列离子方程式。
__________![]() +__________Fe2++__________H+
+__________Fe2++__________H+![]() __________Mn2++__________Fe3++__________H2O
__________Mn2++__________Fe3++__________H2O
③称量上述含铁元素质量分数为20.00%的“速力菲”
(2)已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸。含
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市崇明县高三上学期期末(一模)考试化学试卷(解析版) 题型:填空题
部分弱酸的电离平衡常数如下表:
|
弱酸 |
HCOOH |
HClO |
H2CO3 |
H2SO3 |
|
电离平衡常数 (25℃) |
|
|
|
|
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A.2ClO- + H2O + CO2 → 2HClO + CO32-
B.2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C.H2SO3 + 2HCOO- → 2HCOOH + SO32-
D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是…………………………………( )
A.H2O2既是氧化剂又是还原剂
B.H2O 既不是氧化产物又不是还原产物
C.H2SeO4既是氧化产物又是还原产物
D.氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸, ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
HI+ H6TeO6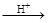 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O
(6)若反应中生成的TeO2与Te的物质的量之比为 ,试配平上述化学方程式。
,试配平上述化学方程式。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省西安市高三第一次质检化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.用氢氧化钠溶液除去铝片表而上的氧化膜:Al3++4OH-=AlO2-+2H2O
B.在含3.2amolHNO3的稀溶液中,加入amol铁粉:5Fe+4NO3-+16H+=3Fe2++2Fe3++4NO↑+8H2O
C.澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.过氧化氢能使酸性KMnO4溶液褪色:3H2O2+2MnO4-+6H+=2Mn2++4O2↑+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com