
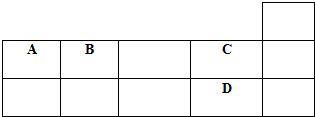
| A、原子半径的大小为A>B>C>D |
| B、D的氢化物在同族元素的氢化物中沸点最低 |
| C、生成氢化物的稳定性为A>B>C>D |
| D、A、B、C、D的单质常温下均不导电 |


科目:高中化学 来源: 题型:
| A、24 g氢化钠(NaH)固体中阴离子所含电子总数为2NA |
| B、1 mol/L FeCl3溶液中Fe3+的数目小于NA |
| C、在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA |
| D、标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 样品甲 | 生成白色沉淀,继续滴加氢氧化钠溶液,沉淀消失 |
| 样品乙 | 生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| C | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
| D | 向浓度均为0.1mol?L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3 溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有④⑤⑦⑧ |
| B、只有①②③⑤ |
| C、只有①②③④⑧ |
| D、只有②③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]的空间构型为正四面体形 |
| B、NaOH中既有离子键又有共价键和配位键 |
| C、电解饱和食盐水的实验中阳极产生NaOH |
| D、在[Cu(NH3)4]2+离子中,Cu2+提供孤对电子对,NH3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com