
 .
.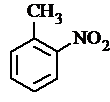 、
、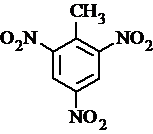 等
等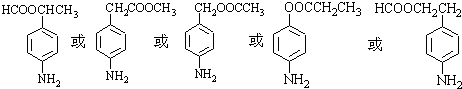 .
. 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
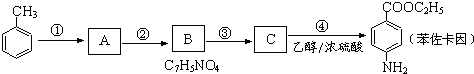
分析 在反应④中,C与乙醇发生酯化反应生成苯佐卡因,则C应为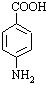 ,根据题给B的分子式为C5H7NO4可知B为
,根据题给B的分子式为C5H7NO4可知B为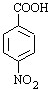 ,由题给信息:①当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位,所以A为
,由题给信息:①当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位,所以A为 ,据此分析解答.
,据此分析解答.
解答 解:在反应④中,C与乙醇发生酯化反应生成苯佐卡因,则C应为 ,根据题给B的分子式为C5H7NO4可知B为
,根据题给B的分子式为C5H7NO4可知B为 ,由题给信息:①当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位,所以A为
,由题给信息:①当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位,所以A为 ,
,
(1)根据以上分析,反应①为甲苯在浓硫酸作用下与浓硝酸发生硝化反应生成 ,为取代反应,反应②为
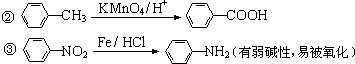
,为取代反应,反应②为 在高锰酸钾条件下被氧化生成
在高锰酸钾条件下被氧化生成 ,为氧化反应,反应③为
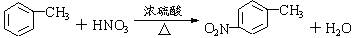
,为氧化反应,反应③为 在铁、HCl作用下发生还原反应生成
在铁、HCl作用下发生还原反应生成 ,为还原反应,反应④为
,为还原反应,反应④为 与乙醇发生酯化反应生成苯佐卡因,则为取代反应;C为
与乙醇发生酯化反应生成苯佐卡因,则为取代反应;C为 含有的含氧官能团的名称为羧基,
含有的含氧官能团的名称为羧基,
故答案为:①④; 羧基;
(2)反应①为甲苯在浓硫酸作用下与浓硝酸发生硝化反应生成 ,反应的化学方程式为
,反应的化学方程式为 ,
,
故答案为: ;
;
(3)a、根据题给信息,甲苯和与浓硝酸发生邻位取代或生成三硝基甲苯,故a正确;
b、因为当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位,所以当步骤①和②互换时,先氧化成羧基,再取代则就不是对位而是间位,故b错误;
c、反应③为 在铁、HCl作用下发生还原反应生成
在铁、HCl作用下发生还原反应生成 ,为还原反应,故c正确;
,为还原反应,故c正确;
故答案为:ac;
(4)①有两个对位取代基; ②-NH2直接连在苯环上; ③分子结构中含有酯基,则符合条件的同分异构体为 .
.
故答案为: ;
;
(5)采用逆推法,要合成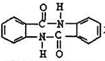 ,则要得到
,则要得到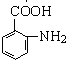 ,模仿流程中用甲苯到C的反应,不同的是在邻位取代,则流程图为:
,模仿流程中用甲苯到C的反应,不同的是在邻位取代,则流程图为: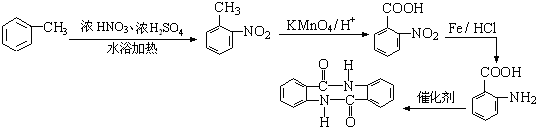 ,
,
故答案为: .
.
点评 本题考查有机物的合成及推断,题目难度较大,注意在有机合成中渗透了苯环取代中的邻对位基团和间位基团的选择,同时考查了同分异构体的书写,难点为(5),利用好流程图中信息.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
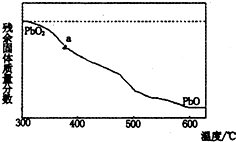 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 1:1 | C. | 1:2 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度均降低 | |
| B. | SO2能使品红溶液和溴水均褪色 | |
| C. | 氯水和浓硝酸均要盛装在棕色试剂瓶中 | |
| D. | NaCl固体中混有NH4Cl或I2,均可用加热法除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量NaOH反应,转移的电子数为NA | |
| B. | 常温常压下,11.2 L甲烷中含有的氢原子数小于2 NA | |
| C. | 1 mol碳烯(:CH2)所含的电子数目为6 NA | |
| D. | T℃时,1 L pH=6的纯水中含OH-数为10-6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、K+、AlO2-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com