
化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:

下列有关叙述正确的是
A.I在空气中能稳定存在
B.II中所有原子均有可能共面
C.可用FeCl3溶液鉴别有机物II和III
D.1mol产物III与足量溴水反应,消耗Br2的物质的量为1.5mol
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:填空题
(10分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)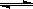 C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。

试回答下列问题:
(1)800℃时,0—5min内,以B表示的平均反应速率为________。
(2)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=______,该反应为_____反应(填吸热或放热)。
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应________进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
A.元素X的简单气态氢化物的热稳定性比W的弱
B.元素W的最高价氧化物对应水化物的酸性比Z的弱
C.原子半径的大小顺序:ry > rz > rw > rx
D.化合物YX、ZX2、WX3中化学键类型相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:选择题
现有1.0 mol/L的NaOH溶液0.2L,若通入4.48L(标准状况)SO2气体使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是
A.c(Na+) = c(H2SO3) + c(HSO3―) + c ( H+)
B.c(SO32―) + c( OH―) = c(H+) + c(H2SO3)
C.c(Na+)+c(H+) = c(HSO3―) +c(SO32―) + c( OH―)
D.c(Na+)>c(HSO3―)>c( OH―)>c(H2SO3)>c(SO32―)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:填空题
(14分)下图所示为某一药物F的合成路线:

(1)A中含氧官能团的名称分别是 、 。
(2)步骤Ⅱ发生反应的类型是 。
(3)写出步骤Ⅲ的化学反应方程式 。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式: 。
①不含甲基;
②是 的衍生物,且环上只有一个取代基;
的衍生物,且环上只有一个取代基;
③能发生银镜反应和水解反应(不考虑 的变化)。
的变化)。
(5)请参照上面合成路线,以间二甲苯、ClCH2COCl、(C2H5)2NH为有机原料(无机试剂任选)合成 。
。
提示:① ;
;
②合成路线流程图示例: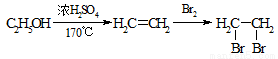 。
。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
下列有关实验装置(部分夹持装置已省略)进行的相应实验,能达到实验目的的是
A.用图1所示装置可制取Cl2
B.用图2所示装置可完成“喷泉”实验
C.用图3所示装置可制取并收集干燥纯净的NH3
D.用图4所示装置可用于实验室制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:填空题
(12分)物质结构选修模块题
(1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解。这三种分子的中心原子与氢原子形成的σ键能由大到小的顺序是 ;其中水分子里的氧原子轨道的杂化类型是 。将过量氨气通入0.1 mol·L―1的蓝色硫酸铜溶液中逐渐形成深蓝色溶液,其离子方程式为: 。
(2)用钛锰储氢合金储氢,与高压氢气钢瓶相比,具有重量轻、体积小的优点。下图是金属钛的面心立方结构晶胞示意图,则钛晶体的1个晶胞中钛原子数为 ,钛原子的配位数为 。
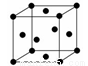
(3)晶体硅、锗是良好的半导体材料。磷化铝、砷化镓也是重要的半导体材料,从物质结构的角度分析它们与晶体硅的关系为 。试以原子实的形式写出31号半导体元素镓的电子排布式 。镓与砷相比较,第一电离能更大的是 (用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下列物质性质与相应结果或应用的对应关系正确的是
A.酸性越强的含氧酸跟铁片反应产生氢气越快
B.将草木灰和硫铵混合施用,可使肥效更高
C.Mg(OH)2和Al(OH)3受热易分解,常用它们作阻燃剂
D.某地雨水经过一段时间,其pH由4.68降为4.28,因为水中溶解了较多的CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:填空题
【化学——选修2化学与技术】(15分)
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
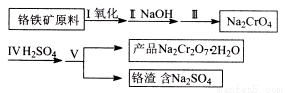
①步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2= 8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为 。在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
A.升高温度 B.通入过量的空气
C.将原料粉碎 D.增加纯碱的用量
②步骤II中所得溶液显碱性,其中除含有Na2C rO4外还含有铝、硅元素的化合物,它们的化学式可能是 。
③步骤III需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为:____。
(2)将红矾钠与KC1固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体,反应方程式为:Na2CrO4 +2KCl= K2Cr2O7 +2NaCl(已知NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大),基本实验步骤为:①溶解;② ;③____ 。
④冷却、结晶,过滤,得到K2Cr2O7晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com