
对于密闭容器中进行的反应CO(g) + H2O(g) CO2 (g) +H2 (g),达到平衡后,其他条件不变,增大CO的浓度,下列说法不正确的是
CO2 (g) +H2 (g),达到平衡后,其他条件不变,增大CO的浓度,下列说法不正确的是
A.正反应速率增大
B.逆反应速率减小
C.达到平衡时,逆反应速率比原平衡要大
D.化学平衡常数不变
科目:高中化学 来源:2014-2015安徽省淮南市高二上学期期末考试化学(文)试卷(解析版) 题型:选择题
学校运动会中,某同学长跑后感到头晕乏力(血糖降低的原因),口服下面哪种物质可有效缓解其症状
A.葡萄糖 B.矿泉水 C.补血口服液 D.鸡蛋
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西岐山县高一上学期期末质量检测化学试卷(解析版) 题型:选择题
下列各组物质相互反应能得到Al(OH)3的是
A.铝与NaOH溶液反应 B.AlCl3与过量的氨水反应
C.AlCl3与过量的NaOH溶液反应 D.Al2O3与过量的NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:填空题
(10分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)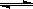 C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。

试回答下列问题:
(1)800℃时,0—5min内,以B表示的平均反应速率为________。
(2)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=______,该反应为_____反应(填吸热或放热)。
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应________进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
在一密闭容器中,反应aA(g)  bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.a>b
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH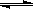 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向逆反应方向移动
B.升高温度,平衡向正反应方向移动
C.加入水稀释,溶液中c(H+)一定增大
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省弥勒市高三市统测一模理综化学试卷(解析版) 题型:推断题
选考【化学—选修5:有机化学基础】 (15分)
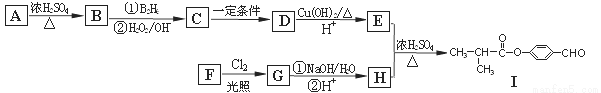
有机物Ⅰ可以用E和H在一定条件下合成:
请根据以下信息完成下列问题:
①A为丁醇且核磁共振氢谱有2种不同化学环境的氢;
②
③一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)B的分子式为: 。
(2)C→D、G→H的反应类型为 、 。
(3)芳香族化合物F的分子式为C7H8O,苯环上的一氯代物只有两种,则F的结构简式为: 。
(4)D生成E的化学方程式为 。
E与H反应生成I的方程式为 。
(5)I的同系物K相对分子质量比I小28。K的结构中能同时满足如下条件:①苯环上只有两个取代基;②分子中不含甲基。共有 种(不考虑立体异构)。试写出上述同分异构体中任意一种消耗NaOH最多的有机物结构简式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
A.元素X的简单气态氢化物的热稳定性比W的弱
B.元素W的最高价氧化物对应水化物的酸性比Z的弱
C.原子半径的大小顺序:ry > rz > rw > rx
D.化合物YX、ZX2、WX3中化学键类型相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:填空题
(12分)物质结构选修模块题
(1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解。这三种分子的中心原子与氢原子形成的σ键能由大到小的顺序是 ;其中水分子里的氧原子轨道的杂化类型是 。将过量氨气通入0.1 mol·L―1的蓝色硫酸铜溶液中逐渐形成深蓝色溶液,其离子方程式为: 。
(2)用钛锰储氢合金储氢,与高压氢气钢瓶相比,具有重量轻、体积小的优点。下图是金属钛的面心立方结构晶胞示意图,则钛晶体的1个晶胞中钛原子数为 ,钛原子的配位数为 。
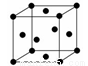
(3)晶体硅、锗是良好的半导体材料。磷化铝、砷化镓也是重要的半导体材料,从物质结构的角度分析它们与晶体硅的关系为 。试以原子实的形式写出31号半导体元素镓的电子排布式 。镓与砷相比较,第一电离能更大的是 (用元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com