
常温时,将某浓度的CH3COOH溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应生成盐和水(若混合体积变化忽略不计),则下列有关所得混合液的说法正确的是:
A.混合后溶液pH=7
B.所得混合溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.所得混合溶液中存在c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1
D.混合后溶液中存在c(Na+)+c(H+)=c(CH3COOH)+c(CH3COO-)
C
【解析】
试题分析:A、醋酸与氢氧化钠溶液反应恰好生成盐和水,则该盐为醋酸钠,为强碱弱酸盐,溶液呈碱性,pH>7,错误;B、因为溶液呈碱性,所以c(H+)<c(OH-),错误;C、氢氧化钠的pH=13,则氢氧化钠的浓度是0.1mol/L,恰好生成醋酸钠时,则醋酸的浓度也是0.1mol/L,二者等体积混合后,c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1,正确;D、根据电荷守恒,则c(Na+)+c(H+)=c(OH-)+c(CH3COO-),而c(OH-)> c(CH3COOH),所以c(Na+)+c(H+)=c(CH3COOH)+c(CH3COO-)不成立,错误,答案选C。
考点:考查酸碱混合的计算


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015湖南省娄底市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.Mg的摩尔质量是24g
B.用酒精可以萃取碘酒中的碘
C.微生物可以用摩尔作单位
D.胶粒直径在1~100nm,光照胶体有光的通路
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省清远市高三上学期期末理综化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的作用。下列有关说法不正确的是
A.雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同
B.氢氧化铁溶胶、蔗糖溶液、淀粉溶液均具有丁达尔效应
C.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油
D.只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:填空题
(14分)汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

则该反应的热化学方程式为_____________________________。
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx == 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积_____________________L。
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇: CO(g)+2H2(g)  CH3OH(g);△H= -b kJmol-1
CH3OH(g);△H= -b kJmol-1
①该反应的平衡常数表达式为_____________________________。
②若容器容积不变,下列措施可增加甲醇产率的是______________
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
③经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO) =0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1, 则此时v正___________v逆(填>、<或=)。
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为_____________________________。电池工作时,固体电解质里的O2-向_______极移动。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
用惰性电极电解 M(NO3) x的水溶液, 当阴极上增重a g时, 在阳极上同时产生b L氧气( 标准状况),从而可知 M 的原子量为:
A. B.
B.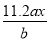 C.
C. D.
D.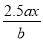
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是:
A.硫酸铜的溶解度 B.溶液的质量
C.溶液中溶质的质量分数 D.溶液中Cu2+的数目
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关,下列说法正确的是
A、“歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料
B、工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质
C、Fe3O4俗称铁红,常做红色油漆和涂料
D、燃料电池的燃料都在负极发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝 | 证明溶液中有NH4+ |
B | 向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊 | 证明该溶液中存在SO32- |
C | 将Cl2通入品红溶液中,品红溶液褪色 | 证明Cl2的还原性 |
D | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明氧化性:H2O2比Fe3+强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:
2SO2(g)+O2(g)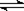 2SO3(g);
2SO3(g); kJ·mol-1。实验测得起始、平衡时的有关数据如下表:
kJ·mol-1。实验测得起始、平衡时的有关数据如下表:
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系 能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是
A.Q1=Q2=Q3=197 kJ。
B.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1>-197 kJ·mol-1。
C.甲、乙、丙3个容器中反应的平衡常数不相等。
D.达到平衡时,丙容器中SO2的体积分数最小。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com