
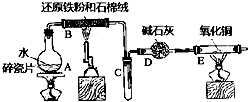
 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)分析 (1)铁与水蒸气在高温下反应生成四氧化三铁和氢气;
(2)氢气能够还原氧化铜生成铜和水,据此判断现象;
(3)①Fe原子核外电子排布为1s22s22p63s23p63d64s2,原子形成阳离子失去高能层中该能级电子,再失去同能层中低能级电子,然后再失去低能层中电子;
②三价铁离子能够与硫氰酸根离子发生络合反应生成血红色的络合物;
③三价铁离子能够氧化铁粉生成二价铁离子;
④高锰酸钾具有强的氧化性,酸性环境下能够氧化二价铁离子生成三价铁离子,本身被还原为二价锰离子;
⑤氯气氧化氯化亚铁生成氯化铁.
解答 解:(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气,化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)铁与水蒸气反应生成的氢气能够与氧化铜发生氧化还原反应生成铜和水,所以会看到现象:黑色氧化铜变红,玻璃管右端出现无色液滴;
故答案为:黑色氧化铜变红,玻璃管右端出现无色液滴;
黑色氧化铜变红,玻璃管右端出现无色液滴
(3)①Fe原子核外电子排布为1s22s22p63s23p63d64s2,原子形成阳离子失去高能层中该能级电子,再失去同能层中低能级电子,然后再失去低能层中电子,故基态Fe3+的价电子排布式可表示为3d5,
故答案为:3d5;
②三价铁离子能够与硫氰酸根离子发生络合反应生成血红色的络合物,通常用硫氰化钾(KSCN)碱液三价铁离子,现象为溶液变红;
故答案为;硫氰化钾(KSCN); 溶液变红;
③三价铁离子能够氧化铁粉生成二价铁离子,离子方程式:2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe=3Fe2+;
④高锰酸钾具有强的氧化性,酸性环境下能够氧化二价铁离子生成三价铁离子,本身被还原为二价锰离子,离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
⑤氯气氧化氯化亚铁生成氯化铁,不会引人新的杂质;
故答案为:Cl2.
点评 本题以FeCl3•6H2O晶体制备为载体,考查了铁及其化合物的性质,明确相关物质的性质是解题关键,注意铁离子的检验方法,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一个化学过程的示意图.请根据该示意图完成下列题目:
如图是一个化学过程的示意图.请根据该示意图完成下列题目:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应中有1 mol H2C2O4参加反应,转移电子总数为6NA | |
| B. | 该反应配平后H+的化学计量数为6 | |
| C. | 该反应右边横线上的产物为OH- | |
| D. | 该反应的氧化剂为H2C2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

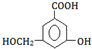
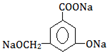 .
.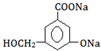 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
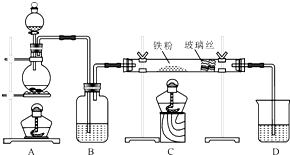 工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.
工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| |温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com