
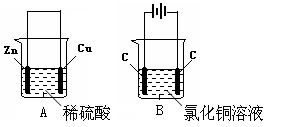
 Cu+Cl2↑
Cu+Cl2↑  Cu+Cl2↑。
Cu+Cl2↑。

科目:高中化学 来源:不详 题型:单选题
| A.铜锌原电池中铜是负极 | B.用电解法粗炼粗铜时,粗铜作阴极 |
| C.在镀件上电镀铜时可用金属铜作阳极 | D.电解稀硫酸制H2和O2时铜作阳极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
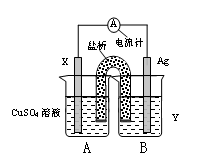
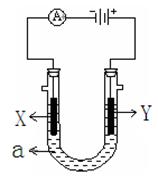
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e- =4OH- | D.Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将水加热,Kw增大,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的Cu(NO3)2溶液时,当有0.2 mole-转移时会析出6.4g铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
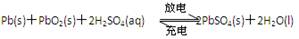
| A.放电时,电子由Pb通过外电路转移到PbO2 |
| B.充电时阴极反应:PbSO4+2e?=Pb(s)+SO42?(aq) |
| C.充电时,电源的正极接铅蓄电池标“?”的一极 |
| D.“无液干粉”铅蓄电池中的电解质溶液不易发生泄漏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
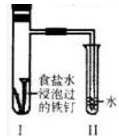
| A.过一段时间,Ⅱ试管中的导管内水柱上升 |
| B.Ⅰ试管中铁钉由于发生电解反应而被腐蚀 |
| C.铁钉在该试管中的腐蚀速度越来越快 |
| D.Ⅰ试管中铁钉发生反应的一个电极方程式为:2Cl—-2e—=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
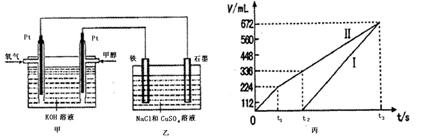
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com