
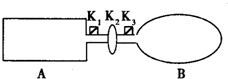
 现有一可导热体积固定的密闭容器A,和一可导热容积可变的容器B.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2?N2O4;△H<0)
现有一可导热体积固定的密闭容器A,和一可导热容积可变的容器B.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2?N2O4;△H<0)| m |
| M |
| m |
| M |
| 4.6g |
| 46g/mol |
| x |
| 2 |
| x |
| 2 |
| 4.6 | ||
0.1-x+
|
| x |
| 2 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com