
 如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:分析 (1)该电解池中,Y是阳极,X是阴极,且都是惰性电极,电解时阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,无色酚酞遇碱变红色;
(2)若X、Y都是铜电极,a是浓度均为2mol•L-1的AgNO3与Cu(NO3)2的混合溶液1L,阳极反应为Cu2++2e-=Cu,阴极首先析出银,然后析出铜;
(3)电解方法精炼粗铜,电解液a选用CuSO4溶液,粗铜做阳极,精铜做阴极,结合电极反应判断;
(4)用惰性电极电解CuSO4溶液,在阳极上是氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2↑,n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据电子守恒计算.
解答 解:(1)①Y为阳极,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
②X是阴极,且是惰性电极,电解时阴极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,同时溶液中生成氢氧化钠,无色酚酞遇碱变红色,所以看到的现象是溶液变红色,
故答案为:气体放出,溶液变红;
(2)由于氧化性Ag+>Cu2+,阳极首先发生Ag++e-=Ag,然后发生Cu2++2e-=Cu,所以电解过程中有关反应的离子方程式4Ag++2H2O $\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+,2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,电解一段时间后X电极上有3.2g铜析出,说明Ag已经全被析出,共转移电子应为n(Ag+)+2n(Cu2+)=2mol+$\frac{3.2g}{64g/mol}$×2=2.1mol,
故答案为:4Ag++2H2O $\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+,2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+;2.1;
(3)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e-=Cu,故答案为:纯铜; Cu2++2e-=Cu;
②精炼粗铜(含有Fe、Zn、Pt、C等杂质),阳极为粗铜先是锌、铁失电子生成离子,而阴极是溶液中的铜离子得电子析出铜单质,则硫酸铜溶液的浓度变小,
故答案为:变小;
(4)用惰性电极电解CuSO4溶液,在阳极上是氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2↑,n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,转移0.5mol×4=2mol电子,由方程式可知Pb+PbO2+2H2SO4=2PbSO4+2H2O,消耗2mol硫酸,故答案为:2mol.
点评 本题考查了电解原理的分析应用,为高频考点,侧重学生的分析能力和计算能力的考查,主要是电极反应和电极判断,电子守恒是电化学计算的依据,难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题

| A. | 容量瓶、分液漏斗和滴定管都需要验漏 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙加热分解NaHCO3固体 | |
| D. | 配制500mL0.1mol•L?1NaCl溶液用到的玻璃仪器只有500mL容量瓶、烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量铜粉后,搅拌、可过滤可除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 通过装有NaOH溶液的确洗气瓶来除去CO2中混有的HCl气体 | |
| C. | 某无色未知溶液中加入BaCl2溶液,有白色沉淀,可推断溶液中的一定含有SO42- | |
| D. | 未知溶液中加入盐酸产生使澄清石灰水变浑浊的气体,则溶液中一定大量含CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;B的结构简式是
;B的结构简式是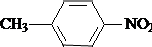 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 M和N单质燃烧时均放出大量热,可用作燃料.已知M和N均为短周期元素,其原子的第一至第四电离能如下表所示:
M和N单质燃烧时均放出大量热,可用作燃料.已知M和N均为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| M | 932 | 1821 | 15390 | 21771 |
| N | 738 | 1451 | 7733 | 10540 |
 ,MCl2是非极性(填“极性分子”或“非极性分子”);N的核外电子排布如图所示,该同学所画的电子排布图违背了能量最低原理.
,MCl2是非极性(填“极性分子”或“非极性分子”);N的核外电子排布如图所示,该同学所画的电子排布图违背了能量最低原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) $?_{500℃/30MPa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 含 1mol NaOH的稀溶液分别和含1mol CH3COOH、1mol HNO3的稀溶液反应,后者比前者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )| A. | 正极反应为:Zn-2e-→Zn2+ | B. | 盐桥中K+向右池移动 | ||
| C. | Pt电极上有气泡出现 | D. | 左烧杯中溶液的红色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe2+与足量的H2O2溶液反应,转移2nA个 | |
| B. | 1L0.1mol•L-1的氨水含有0.1nA个OH- | |
| C. | 常温常压下,22.4LCCl4含有个nA个CCl4分子 | |
| D. | 常温下,23g NO2含有nA个氧原子电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com