
| A、加入KSCN显红色的溶液:K+、NH+4、Cl-、S2- |
| B、“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+ |
| C、pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
| D、无色溶液中:K+、CH3COO-、HCO3-、MnO4- |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
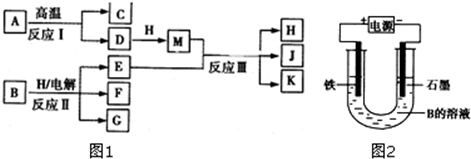
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲基橙显黄色的溶液:AlO2-、HCO3-、Na+、K+ |
| B、c(H+)=1×10-1mol?L-1的溶液:IO3-、I-、K+、NH4+ |
| C、各离子物质的量浓度相等的溶液:K+、Na+、SO42-、NO3- |
| D、无色透明的溶液:NH4+、Na+、Cl-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、7.8gNaS和 Na2O2中含有的阴离子数等于0.1NA |
| C、50mL18.4mol L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA |
| D、常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
| C、用Al(OH)3制胃酸过多 |
| D、电解AlCl3饱和溶液,可制得金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b | B、a<b |
| C、a=b | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中硫酸作氧化剂 |
| B、该反应显示硫酸具有酸性 |
| C、刺激性气味的气体是氨气 |
| D、NH4CuSO3中铜元素全部被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径大小:C>D>E>A |
| B、A、C的氧化物均可能含有非极性键 |
| C、B、C、D的最高价氧化物对应的水化物能两两反应 |
| D、工业中常用电解熔融DE3制备单质D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com