
ͭ����ĵ��ʼ��仯������������������Ӧ�ù㷺����ͭ����Ҫ�ɷ���Cu2S����ұ��ͭ�����������Ҫԭ�ϡ�
��1����֪����2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ��H=-768.2kJ/mol
��2Cu2O(s)+ Cu2S(s)=6Cu(s)+ SO2(g) ��H=+116.0kJ/mol
��Cu2S(s)+O2(g)=2Cu(s)+SO2(g) ��H=__________��
��2�����û�ʯȼ�Ͽ��ɡ��ӹ����̲�����H2S��������ȡ�������������ֻ��������õ�56L(��״��)��������ת�Ƶĵ�����Ϊ________��
��3������ұ�������л����������SO2�����մ���SO2�����ܷ�ֹ������Ⱦ�������ܱ亦Ϊ�������մ����ķ���֮һ���Ƚ�SO2ת��ΪSO3��Ȼ����ת��ΪH2SO4��
��450��ʱ��ij�����ܱ������д��ڷ�Ӧ��2SO2(g)��O2(g) 2SO2(g)��H��0��������ʵ�ܱ����÷�Ӧ�ﵽƽ�����___________��
2SO2(g)��H��0��������ʵ�ܱ����÷�Ӧ�ﵽƽ�����___________��
A.�����������ܶȲ��� B.O2��SO2����������֮��Ϊ1:2
C.n(SO2):n(O2):n(SO3)=2:1:2 D.������ѹǿ���ٷ�������
��450�桢0.1Mpa�£���2.0molSO2��1.0molO2����5L�ܱ������п�ʼ��Ӧ�������¶Ⱥ�����������䣬SO2��ת����(a)����ʱ�䣨t���ı仯��ͼ1��ʾ������¶��·�Ӧ��ƽ�ⳣ��K=_____����ά�������������䣬ʹ��Ӧ��ʼʱ�¶����ߵ�500�� ������ͼl�л�����Ӧ�ӿ�ʼ��ƽ��ʱSO2ת���ʵı仯ͼ��_______��
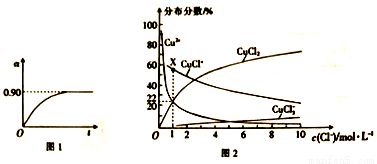
��4����֪CuCl2��Һ�У�ͭԪ�صĴ�����ʽ��c(Cl-)����Դ�С�йأ����������ͼ2��ʾ���ֲ�������ָƽ����ϵ�и���ͭ�����ʵ���ռͭԪ�������ʵ����İٷֱȣ���
������Һ�к�ͭ������Ũ��Ϊamol/L����X���Ӧ��c(CuCl+)=___________ ���ú�a�Ĵ���ʽ��ʾ����
����c(Cl-)=1mol/L���Ȼ�ͭ��Һ�е�������AgNO3��Һ����Ũ�����ĺ�ͭ��������Ӧ�����ӷ���ʽΪ__________��
 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ̫ԭ�и�һ3�½��Բ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪�����ͬ���壬���ж��ȼ��仯�����������ȷ����
A. ̼����������ˮ B. �������ȵļ��Ա�����������
C. �����ȸ���ˮ����Ӧ D. ���ǵ�������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���Ͽ���ѧ2016-2017�������Ĵ��¿����ۻ�ѧ�Ծ� ���ͣ�ѡ����
�����淴Ӧ��ƽ��ı䷴Ӧ��������仯������ȷ����
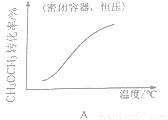
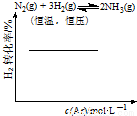
A. CH3OCH3(g)+3H2O(g)  6H2(g) + 2CO2(g)�� ��H>0
6H2(g) + 2CO2(g)�� ��H>0
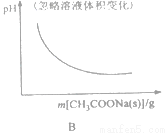
B. CH3COOH H++CH3COO-
H++CH3COO-
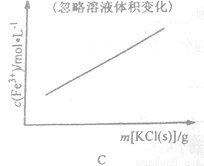
C. FeCl3+3KSCN Fe(SCN)3+3KCl
Fe(SCN)3+3KCl
D. N2(g) +3H2(g) 2NH3(g)
2NH3(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и�һ��ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����FeBr2��FeI2����Һ��ͨ��һ������������������Һ�еμ�KSCN��Һ����Һ��Ϊ��ɫ����������������ȷ����
A. ͨ������֮��ԭ��Һ�е�Fe2+ȫ��������
B. ͨ�����������Һ��һ��������I��
C. ԭ��Һ�е�Br�����ܱ�����
D. ��ȡ����������Һ���ټ���CCl4��Һ��������á���Һ���²���Һ���ܳ��Ϻ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и�һ��ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ʵ�����������ʵı��淽���У�����ȷ����
A. ��Ƭ���Ա����ڲ��ܷ�������
B. ����������Һʢװ�ڴ����������Լ�ƿ��
C. ����������Һ����ڼ����������۵��Լ�ƿ��
D. ���Ƶ���ˮӦ�ܹⱣ�棬�����䰵��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������������2017�������һ��ģ��������ۻ�ѧ�Ծ� ���ͣ�ѡ����
��Ҷȩ(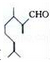 )��һ����Ҫ�����ϣ�������������������ɶ�������ױ�(
)��һ����Ҫ�����ϣ�������������������ɶ�������ױ�(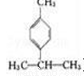 )�������й���Ҷȩ���������ױ���������ȷ����
)�������й���Ҷȩ���������ױ���������ȷ����
A. ����Ϊͬ���칹��
B. ���߾�������ˮ��Ӧ�ӳɷ�Ӧ
C. ��Ҷȩ��һ��ͬ���칹������Ƿ��㴼
D. ��������ױ��ķ���ʽΪC10H14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʦ����ѧ������ѧ��һ3���¿���ѧ�Ծ��������棩 ���ͣ������
�����������ʣ�CO2��N2��CaCl2��NH4Cl��NaOH��H2O2��Na2O2��
(1)���ڹ��ۻ��������_______________�����зǼ��Լ������ӻ��������__________��
(2)N2��CO2�Ľṹʽ�ֱ�Ϊ________________��_________________��
(3)�ֱ�д��NaOH��H2O2��Na2O2�ĵ���ʽ��_______________��_____________��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡʯ��ׯ�и�����ѧ��ģ�����������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
��ʽ̼��ͭ��Cu2(OH)2CO3��������Ŀ��ﱦʯ��ȸʯ����Ҫ�ɷ֣�Ӧ�ù㷺����������ҵ�������������ͭ������л���ҵ�������л��ϳɴ����ȵȣ�ij��ѧС��Ϊ��̽����ʽ̼��ͭ��������������ʵ�Ӱ�죬���������ʵ�飺
���ԭ����ȡһ�������̼������Һ��0.5mol/L)��100mL�ձ��У����м��ȣ����º�����ͭ��Һ��5.00mL. 0.5mol/L)�ڲ��Ͻ�������һ���ٶ���μ��뵽����̼������Һ�У���Ӧ��ƽ���ֹ����ѹ���ˣ�ϴ�ӣ���ɣ����õ����ղ�Ʒ��ͬʱ������ų���
��1����Ӧԭ��Ϊ��________________��
��2��̽����Ӧԭ�������ȶԷ�Ӧ�����Ӱ�졣
�û�ѧС��������ṩ�Լ���֭����ʵ����˵����Ӧԭ�������Բ�Ʒ��Ӱ��
�ṩ�Լ���0.5mol/LNa2CO3��Һ��0.5mol/LCuSO4��Һ��
������д�±��Ŀհ״���
�� | �� | �� | �� | |
����ͭ��Һ���/mL | 2.0 | 2.0 | 2.0 | 2.0 |
̼������Һ���/mL | 1.6 | 2.0 | 2.8 | |
Na2CO3/CuSO4mol/��) | 0.8 | 1 | 1.4 |
��ͨ��ʵ�黭ͼ��֪������ֵΪ______����ʽ̼��ͭ������á�
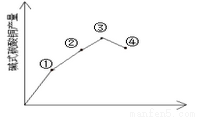
��3����Ӧ�¶ȶԲ��ʵ�Ӱ��
����֧�Թ��и�����2.0mL0.5 mol/LCuSO4��Һ��ȡ��֧�Թܸ�����������ʵ��õ��ĺ���������0.5 mol /L Na2CO3��Һ�����������Թ��и�ȡһ֧�����Ƿքe�������¡�30�桢50�桢100��Ļ����������Ӻ�CuSO4��Һ����Na2CO3��Һ�����۲������֣�������ɫ�ֱ�Ϊ��ɫ��������ɫ����������ɫ��������ɫ�д��к�ɫ������ʵ����Ҳ����ͼ��ʾ����˼����Ϊʲô�¶ȹ��{���ʷ����½�_______����ʵ����ȷ�ʽΪ____________��
��4���������Ƶõļ�ʽ̼��ͭ������������
����ȷ������0.5g������Ʒ����300mL����ƿ�У�����5mL���ᣬ����ʹ���ܽ⣬����l00mLˮ����ϡ�͡�����2.5gKI��ϣ�����5���Ӻ������ε�����Һ����0.1mol/L�������������Һ���еζ�����_______ʱ����ζ����յ㡣
��Ӧ��ԭ����2Cu2++4I- =2CuI+I2��I2+2S2O32-=2I-+S4O62-
��0.lmol/L���������40 mL����ô������ͭ�������ٷ���Ϊ________������Һ�ĵζ���Ϊ_______��������������Һ�൱�ڱ������ʵ���������λ��g/mL��mg/mL)(������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�ɶ������и߶���ѧ����ĩ��⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�Ѻųơ�����ĵ��������������㷺Ӧ���ھ��¡�ҽѧ��������֪����48Ti��49 Ti��50Ti��ͬλ�أ����й��ڽ����ѵ������в���ȷ���ǣ� ����
A. ��Ԫ�������ڱ��д��ڵ������ڢ�B�� B. ������ԭ���У�������������Ϊ22
C. ��ԭ�ӵ���Χ���Ӳ��Ų�Ϊ3d24s2 D. ��Ԫ��λ��Ԫ�����ڱ���d�����ǹ���Ԫ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com