
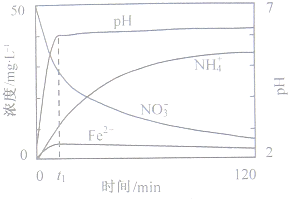
 (2011?安徽)地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
(2011?安徽)地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.

 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
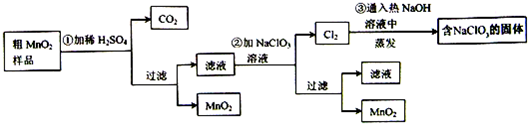
科目:高中化学 来源: 题型:
查看答案和解析>>
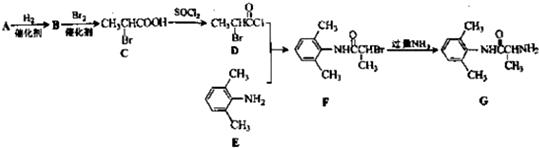
科目:高中化学 来源: 题型:
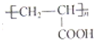 的单体,则A中含有的官能团是
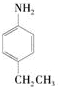
的单体,则A中含有的官能团是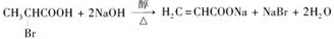
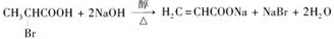
 、
、





查看答案和解析>>
科目:高中化学 来源: 题型:
(2011?安徽)下列有关实验操作、现象和解释或结论都正确的是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com