
| A.④②①⑤③ | B.④①②⑤③ | C.②⑤④①③ |
| D.②④⑤①③ E.⑤②④①③ F.⑤④②①③ |
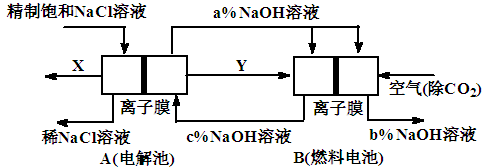


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
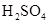 共热制取CO.
共热制取CO.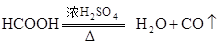
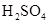 应怎样混合?浓
应怎样混合?浓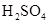 起什么作用?
起什么作用?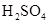 共热制取CO.
共热制取CO.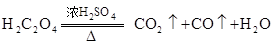
 的CO气体?
的CO气体?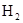 的还原性谁强?
的还原性谁强?查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
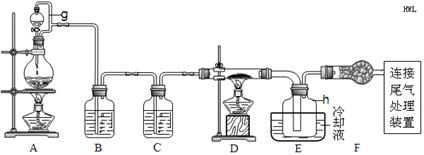
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
 5Fe3++Mn2++4H2O
5Fe3++Mn2++4H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
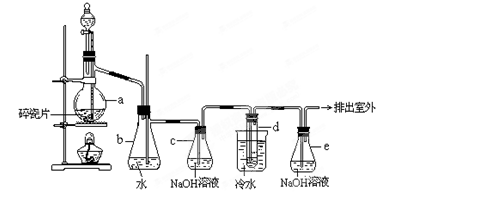
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1: 4 | B.1: 5 | C.2: 1 | D.2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com