
将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.往溶液中滴入无色KSCN溶液,显黄色
C.Fe2+和Fe3+的物质的量之比为6:1
D.氧化产物与还原产物的物质的量之比为2:5
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:填空题
将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+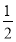 O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+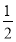 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式:________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:
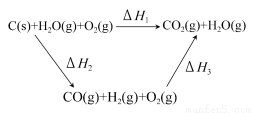
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点________。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇;②甲醛;③甲酸;④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:选择题
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于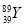 的说法不正确的是( )
的说法不正确的是( )
A.属于金属元素
B.质子数与中子数之差为50
C.原子的核外电子数是39
D.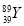 和
和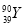 是两种不同的核素
是两种不同的核素
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-3 含硅矿物与信息材料练习卷(解析版) 题型:选择题
炭雕(如图所示)是一种集观赏与空气净化为一体的产品,这种产品可对车内及室内空气中的一氧化碳、苯、甲醛、烟雾等有害气体进行有效吸附。取一块制作炭雕的下脚料,进行下面的实验。下列有关叙述不正确的是( )

A.将炭雕下脚料在空气中点燃,可以得到使澄清石灰水变浑浊的气体
B.将炭雕下脚料研成粉末,加入到稀的红墨水中,红墨水褪色
C.将炭雕下脚料研成粉末,与氧化铜粉末混合加热,可以得到红色固体
D.将炭雕下脚料加入到盛有氯气的集气瓶中,静置一段时间,黄绿色变浅,其原因是炭雕下脚料中的物质与氯气发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷(解析版) 题型:填空题
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生产中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中含有的大量阳离子是________。
(2)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下所示。
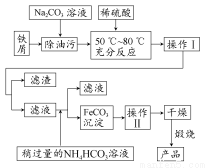
回答下列问题:
①操作Ⅰ所用的分离仪器的名称是________;操作Ⅱ的名称是________,该操作的具体方法是________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)________。
③请写出生成FeCO3沉淀的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷(解析版) 题型:选择题
某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+四种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:
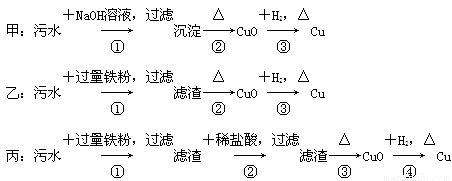
下列判断正确的是( )
A.三种实验方案中都能制得纯净铜
B.乙方案中加过量铁粉可以将四种阳离子全部还原
C.甲方案中的反应涉及到置换、分解、化合、复分解四种反应类型
D.丙方案也会发生环境污染
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(解析版) 题型:实验题
某探究小组用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速度的因素。
实验药品:2.0 mol/L盐酸、4.0 mol/L盐酸、2.0 mol/L硫酸、4.0 mol/L硫酸、相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0 mL,金属用量均为9.0 g。
Ⅰ.甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
反应进程 (分钟) | 1 | 2 | 5 | 15 | 20 |
4.0 mol/L 盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
2.0 mol/L 硫酸 | 无明显现象 | 极少量 气泡 | 少量气泡 | ||
4.0 mol/L 硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
请回答下列问题:
(1)写出铝与盐酸反应的离子方程式: 。
(2)反应在1~15min内,铝与盐酸的反应速率逐渐增大,其原因是 。
(3)根据以上探究“铝与稀盐酸和稀硫酸的反应速率存在差异的原因”,你能对原因作出哪些假设或猜想: (写出一种即可)。
Ⅱ.乙同学设计了如下影响反应速率因素的实验。请你根据实验目的帮助该同学完成以下实验设计表:
实验目的 | 实验 编号 | 温度 /℃ | 金属铝的 形态 | 盐酸浓度 /mol·L-1 |
1.实验①和②探究盐酸浓度对该反应速率的影响; 2.实验①和③探究温度对该反应速率的影响; 3.实验①和④探究金属规格(铝片、 铝粉)对该反应速率的影响 | ① | 25 | 铝片 | 4.0 |
② |
|
|
| |
③ |
|
|
| |
④ |
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-2 钠、镁及其化合物练习卷(解析版) 题型:选择题
将含有O2和CH4的混合气体置于盛有23.4 g Na2O2的密闭容器中,用电火花点燃,反应结束后,容器内的压强为零(150℃),将残留物溶于水中,无气体生成。下列叙述中正确的是( )
①混合气体中O2和CH4的体积比为2:1
②残留物只有Na2CO3
③混合气体中O2与CH4的物质的量之比为1:2
④残留物只有Na2CO3和NaOH
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 13-2 化学资源与材料练习卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列有关说法中不正确的是( )
A.新能源汽车的推广与使用有助于减少光化学烟雾的产生
B.2010年12月10日联合国坎昆气候变化大会,其主要议题是节能减排的低碳经济。低碳经济就是以低能耗、低污染、低排放为基础的经济发展模式
C.华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的单质硅
D.超级病菌NDM-1几乎对所有抗生素都具有抗药性,死亡率很高。为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com