
分析 (1)Mn原子核外电子数为25,处于第四周期ⅦB族,基态电子排布式为:1s22s22p63s23p63d54s2;
(2)中心原杂化轨道数为$\frac{4+2}{2}$=3,所以碳是sp2杂化,[Mn(H2O)6]2+中所含有的σ键数目为6×2个氢氧键和6人配位键,所以1mol[Mn(H2O)6]2+中所含有的σ键数目为18mol;
(3)原子个数相等、价电子数相等的微粒互为等电子体;水分子之间存在氢键;
(4)根据化合代数和为零,Mn3O4中Mn元素的平均化合价为+$\frac{8}{3}$.
解答 解:(1)Mn原子核外电子数为25,处于第四周期ⅦB族,基态电子排布式为:1s22s22p63s23p63d54s2,所以Mn2+基态的核外电子排布式为:1s22s22p63s23p63d5或[Ar]3d5,故答案为:1s22s22p63s23p63d5或[Ar]3d5;
(2)中心原杂化轨道数为$\frac{4+2}{2}$=3,所以碳是sp2杂化,[Mn(H2O)6]2+中所含有的σ键数目为6×2个氢氧键和6人配位键,所以1mol[Mn(H2O)6]2+中所含有的σ键数目为18mol,故答案为:sp2杂化; 18mol;
(3)原子个数相等、价电子数相等的微粒互为等电子体,二氧化碳分子中原子个数是3、价电子数是16,与二氧化碳互为等电子体的阴离子是SCN-,因为 水分子之间存在氢键,氢键强度远大于分子间作用力,所以常温下CO2呈气态,而H2O呈液态,故答案为:SCN-; 水分子之间存在氢键;
(4)根据化合代数和为零,Mn3O4中Mn元素的平均化合价为+$\frac{8}{3}$,所以锰的化合价为:+2 和+3,故答案为:+2 和+3.
点评 本题综合考查物质的结构与性质知识,侧重于电子排布式、等电子体、杂化类型与配位键等知识,题目难度中等,注意把握杂化类型的判断方法,试题知识点较多、综合性较强,充分考查了学生的灵活应用能力.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 升高温度,对正反应的反应速率影响更大 | |
| B. | 增大压强,对正反应的反应速率影响更大 | |
| C. | 减小反应物浓度,对逆反应的反应速率影响更大 | |
| D. | 加入催化剂,同等程度地改变正、逆反反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K=$\frac{[N{H}_{3}][HCl]}{[N{H}_{4}Cl]}$ | B. | K=$\frac{[N{H}_{4}Cl]}{[N{H}_{3}][HCl]}$ | C. | K=[NH3][HCl] | D. | K=$\frac{[N{H}_{3}]}{[N{H}_{4}Cl]}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知尿素(结构简式:
已知尿素(结构简式: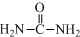 )可用于制有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.回答下列问题.
)可用于制有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量就是物质的质量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 物质的量是含有一定数目粒子的集合体 | |
| D. | H2的摩尔质量为2g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 制取溴苯的装置如下,请回答下列问题:
制取溴苯的装置如下,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com