
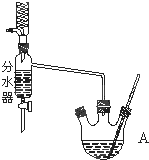
 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题: .
.分析 I.①羧酸脱去羟基,醇脱去氢原子生成乙酸乙酯和水;
②醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基;
II.若温度低,影响反应速率;温度高,不利于乙酸乙酯的生成;
III.装置图的结构特点可知,用分水器能够在反应进行时很容易的把水分离出来;
IV.碳酸钠溶液显示碱性;乙酸乙酯不溶于碳酸钠溶液,混合液分层,颜色不同.
解答 解:I.①酯化反应中羧酸提供羟基,醇应该氢原子,所以反应的机理可以表示为 ;
;
故答案为: ;
;
②由于醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基,因此不能用氢同位素示踪法揭示酯化反应原理,
故答案为:不能; 醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基;
II.①温度低,反应速率低,且达不到催化剂活性温度,所以温度不能低于85℃;
故答案为:反应速率低,达不到催化剂活性温度;
②正反应是放热反应,温度过高利于平衡逆向移动,酯产率降低,所以也不能高于85℃;
故答案为:温度过高利于平衡逆向移动,酯产率降低;
III.根据装置图的结构特点可判断,用分水器能够在反应进行时很容易的把水分离出来,从而降低生成物浓度.使平衡正向移动,提高乙酸乙酯的产率;
故答案为:用分水器能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率;
IV.由于碳酸钠溶液显碱性,能使酚酞试液显红色,所以应该滴入酚酞试液,实验现象是碳酸钠层呈红色,上层的酯层呈无色;
故答案为:酚酞;碳酸钠层呈红色,上层的酯层呈无色.
点评 本田考查了乙酸乙酯的实验室制备原理探究,题目难度中等,试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等体积、等物质的量浓度的氨水与盐酸混合 | |
| B. | 常温下,pH=8的氨水与pH=6的硝酸等体积混合 | |
| C. | 常温下,pH=12的Ba(OH)2溶液与pH=2的NaHSO4溶液等体积混合 | |
| D. | c(H+)=c(OH-)=10-6 mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,FeS,ZnS、CuS的溶解度依次增大 | |
| B. | ZnS饱和溶液中加入少量NazS固体,平衡后溶液中c(Zn2+)•c(S2-)=Ksp(ZnS),c(Zn2+)=c(S2-) | |
| C. | 除去工业废水中的Cu2+,可用FeS作为沉淀剂 | |
| D. | 某溶液中含有Fe2+、Cu2+和Znz+,浓度均为0.010 moI•L-1.向该溶液中逐滴加入0.010 mol•L-1的Na2S溶液时,Fe2+最先沉淀出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
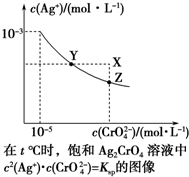 已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )| A. | 在t℃时,Ag2CrO4的Ksp为1×10-11 | |
| B. | 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点 | |
| C. | 在t℃,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO${\;}_{4}^{2-}$(aq)平衡常数K=6.25×107 | |
| D. | 在t℃时,以0.001 mol•L-1 AgNO3溶液滴定20 mL 0.001 mol•L-1 KCl和0.001 mol•L-1的K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.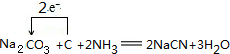 .
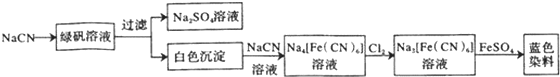
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com