
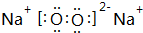
 ,用电子式表示该化合物的形成过程
,用电子式表示该化合物的形成过程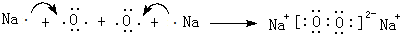 .
.分析 A、B、C、D、E、F、G七种短周期元素,它们的原子序数依次增大,A的原子中没有中子,则A为H元素;B的一种单质是硬度最大的物质,则B为碳元素;D原子的最外层电子数是其电子层数的三倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故D为O元素;C的原子序数介于碳、氧之间,则C为N元素;E与A同一主族,其最高价氧化物对应的水化物的水溶液的碱性在短周期元素中最强,则E为Na;G是地壳中含量最多的金属元,则G为Al;F的原子序数介于钠、铝之间,故F为Mg.
解答 解:A、B、C、D、E、F、G七种短周期元素,它们的原子序数依次增大,A的原子中没有中子,则A为H元素;B的一种单质是硬度最大的物质,则B为碳元素;D原子的最外层电子数是其电子层数的三倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故D为O元素;C的原子序数介于碳、氧之间,则C为N元素;E与A同一主族,其最高价氧化物对应的水化物的水溶液的碱性在短周期元素中最强,则E为Na;G是地壳中含量最多的金属元,则G为Al;F的原子序数介于钠、铝之间,故F为Mg.
(1)D、E元素形成的含有两种类型化学键的化合物为Na2O2,其电子式为 ,用电子式表示该化合物的形成过程:
,用电子式表示该化合物的形成过程: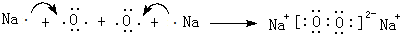 ,
,
故答案为: ;
;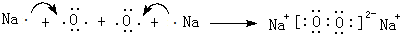 ;
;
(2)Mg的单质置换碳的单质反应的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(3)C与F形成化合物与一定体积一定浓度的盐酸恰好完全反应产生两种盐,应是Mg3N2与HCl反应生成NH4Cl与MgCl2,反应的化学方程式是:Mg3N2+8HCl=3MgCl2+2NH4Cl,
故答案为:Mg3N2+8HCl=3MgCl2+2NH4Cl;
(4)A与B、C 形成的简单化合物分别为CH4、NH3,氨分子间存在氢键,故甲烷的沸点比氨气的低,
故答案为:<;氨分子间存在氢键.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语与元素化合物性质的考查,注意氢键对物质性质的影响.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 图(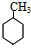 )的一氯代物有4种 )的一氯代物有4种 | |
| B. | 表示甲烷分子或四氯化碳分子的比例模型 | |
| C. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
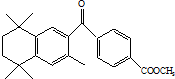 蓓萨罗丁是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,其结构简式如图,下列关于蓓萨罗丁判断正确的是( )
蓓萨罗丁是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,其结构简式如图,下列关于蓓萨罗丁判断正确的是( )| A. | 蓓萨罗丁的分子式为C24H28O3 | |
| B. | 蓓萨罗丁分子中一定有17个碳原子在同一平面内 | |
| C. | 蓓萨罗丁可以与氢气发生加成反应,1mol蓓萨罗丁最多消耗8 mol H2 | |
| D. | 蓓萨罗丁能与NaOH溶液反应,但是不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在所有元素中氢原子半径最小 | |
| B. | Al3+、Na+、O2-微粒半径依次增大 | |
| C. | P、S、Cl最高正价依次升高 | |
| D. | 锂、钠、钾、铷、铯单质的熔点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 其含有的共价键类型是极性共价键.
其含有的共价键类型是极性共价键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32gO2和O3的混合气体所含质子数一定为16NA | |
| B. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| C. | 常温下,5.6 g铁与硝酸反应,失去的电子数一定为0.3 NA | |
| D. | 23g钠与足量氧气充分反应,转移的电子数一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 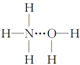 | C. | 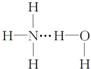 | D. | 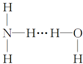 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
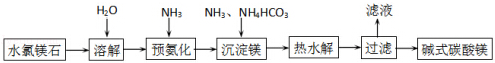
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com