
【题目】X、Y、Z、W、T是原子序数依次増大的五种短周期元素,且X、Y、Z、W的原子序数之和为32。其中X是元素周期表中原子半径最小的元素,Y、Z左右相邻,Z、W位于同一主族。T的单质常用于自来水的杀菌消毒。
请回答下列问题:
(1)W元素在周期表中的位置为:____________________
(2)由 X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该反应的离子方程式为____________________。
(3)Y元素的气态氢化物与其最高价氧化物的水化物可以相互反应,写出其离子方程式:______________
(4)Y和T两元素的非金属性强弱为Y________T (填“>”“<”或者“=”)。可以验证该结论的方法是___________________
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素所形成含氧酸的酸性
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素与氢气化合的难易程度
E.比较这两种元素气态氢化物的还原性
(5)某化学兴趣小组欲通过实验探究元素N、C、Si 非金属性强弱。实验装置如下:
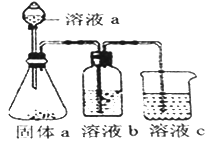
①溶液a和溶液b分别为__________溶液、________溶液(填溶质化学式)
②经验证,N、C、Si的非金属性由强到弱为:__________
【答案】 第三周期第VIA族 3Cu + 8H+ +2NO3- = 3Cu2+ +2NO↑ +4H2O NH3 + H+=NH4+ < CDE HNO3 NaHCO3 N>C>Si
【解析】根据元素的原子序数相对大小、数量关系,然后结合元素在周期表中的相对位置以及有关元素的性质判断出元素种类,最后结合对应单质、化合物的性质以及元素周期律的递变规律逐一分析解答。
X是元素周期表中原子半径最小的元素,应为H元素,Y、Z左右相邻,Z、W位于同一主族,且原子序数依次增大,可设Z的原子序数为a,则Y的原子序数为a-1,W的原子序数为a+8,故有1+a+a-1+a+8=32,a=8,因此Y、Z、W分别为N、O、S元素,T的单质常用于自来水的杀菌消毒,提纯T是Cl。
(1)S元素的原子序数是16,在周期表中的位置为第三周期第VIA族;(2)由 X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该强酸是稀硝酸,反应的离子方程式为3Cu + 8H+ +2NO3- =3Cu2+ +2NO↑ +4H2O;(3)N元素的气态氢化物与其最高价氧化物的水化物可以相互反应生成硝酸铵,其离子方程式为NH3 + H+=NH4+;(4)氯元素的非金属性强于氮元素,A.非金属性强弱与元素的气态氢化物的沸点无关,A错误;B.非金属性越强,最高价含氧酸的酸性越强,因此比较这两种元素所形成含氧酸的酸性不能比较非金属性强弱,B错误;C.非金属性越强,氢化物越稳定,因此比较这两种元素的气态氢化物的稳定性可以比较非金属性强弱,C正确;D.非金属性越强,越容易与氢元素化合,因此比较这两种元素与氢气化合的难易程度可以比较非金属性强弱,D正确;E.非金属性越强,相应阴离子的还原性越弱,因此比较这两种元素气态氢化物的还原性可以比较非金属性强弱,E正确,答案选CDE;(5)①要通过实验探究元素N、C、Si 非金属性强弱,可以依据较强酸制备较弱酸完成。即利用硝酸与碳酸盐反应生成CO2,CO2通入硅酸钠溶液中,由于硝酸易挥发,生成的CO2中混有硝酸气体,所以溶液a和溶液b分别为HNO3溶液、饱和NaHCO3溶液;②经验证,N、C、Si的非金属性由强到弱为N>C>Si。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度下,0.200 molL-1的HA溶液与0.200 molL-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是
微粒 | X | Y | Na+ | A- |
浓度/(mol·L-1) | 8.00 | 2.50 | 0.100 | 9.92 |
A. 0.1mol·L-1HA溶液的pH=1 B. 该温度下Kw=1.0![]() 10-14
10-14
C. 微粒X表示OH-,Y表示H+ D. 混合溶液中:n(A-)+n(X)=n(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数。下列说法正确的是( )
A. 7.8 g Na2O2中含有的阴离子数目为0.2NA
B. 标准状况下,2.24 L CHCl3的分子数为0.1NA
C. 1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA
D. 0.1 mol Fe与足量稀HNO3反应,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乙二醇和丙三醇互为同系物
B. 甲烷、乙烯和苯在工业上都可通过石油分馏得到
C. 可通过酸性高锰酸钾溶液来区别烯烃和炔烃
D. 苯酚对皮肤有腐蚀性,如果不慎粘到手上,应该立即用酒精清洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行探究:
Ⅰ. 鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL0.0001mol/L两种盐溶液的试管中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是装有_____________溶液的试管。
乙同学测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性。该溶液呈碱性的原因是__________(用离子方程式解释)。
Ⅱ. 如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
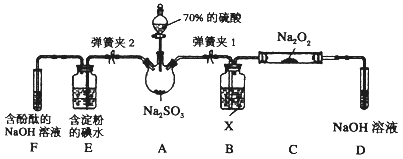
(1)装置B中试剂X是_______,装置D中盛放NaOH溶液的作用是_______________________。
(2)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是_____________________________________。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为______________;发生反应的离子方程式是_____________________。
Ⅲ. 用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入右图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
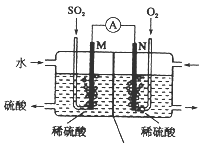
(1)M极发生的电极反应式为____________________________。
(2)若使该装置的电流强度达到2.0 A,理论上每分钟应向负极通入标准状况下气体的体积为_____L(已知:1个e所带电量为1.6×10-19C)。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法,不正确的是
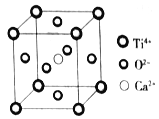
(Ti4+位于顶点上,O2-位于面心上,Ca2+位于中心)
A. 该晶体的化学式为CaTiO3
B. 该晶体中每个Ti4+和8个O2-相紧邻
C. 一个CO2晶胞中平均含有4个CO2分子
D. 金属晶体的熔点可能比分子晶体的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(7分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
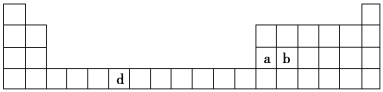
(1)请写出元素d的基态原子电子排布式________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是________。其中b原子的杂化方式是_______。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
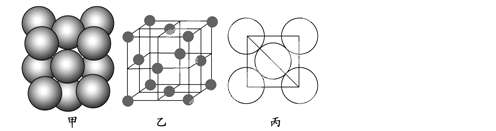
若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为M,则一个晶胞中a原子的数目为________,该晶体的密度为________(用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com