
| ||

| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、PM2.5主要来自工业生产,汽车尾气排放等过程中产生的残留物 |
| B、PM2.5表面积大,能吸附大量有害物质 |
| C、研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染 |
| D、我们要提倡先改善人们的生活质量,随着科技的发展再进行污染的治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲-②,乙-④ |
| B、乙-③,丙-① |
| C、丙-①,丁-② |
| D、丁-②,丙-③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有较多Fe3+的溶液:Na+、SO42-、HS-、NH4+ |
| B、c(OH-)=1mol/L的溶液:AlO2-、CH3COO-、K+、Ba2+ |
| C、pH=1的溶液:K+、Fe2+、NO3-、Na+ |
| D、遇Al能放出H2的溶液:HCO3-、K+、Mg2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学反应原理在工业生产中具有十分重要的意义.
化学反应原理在工业生产中具有十分重要的意义.| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为研究HA、HB溶液和MOH的酸碱性的相对强弱,某化学学习小组设计了以下实验:室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图所示,根据所给数据,请回答下列问题:
为研究HA、HB溶液和MOH的酸碱性的相对强弱,某化学学习小组设计了以下实验:室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图所示,根据所给数据,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
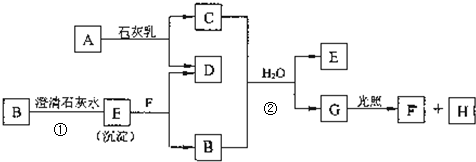
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com