
分析 (1)依据配制溶液体积选择合适的容量瓶,依据m=cvM计算需要溶质的质量;
(2)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,据此排序;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)依据n=CV计算碳酸钠、硫酸的物质的量,依据Na2CO3~H2SO4~CO2计算生成二氧化碳物质的量;依据1mol碳酸钠含有2mol钠离子计算钠离子的物质的量,依据C=$\frac{n}{V}$计算钠离子的物质的量浓度.
解答 解:(1)要配制溶液的体积为240ml,只能选用250ml的容量瓶,Na2CO3的物质的量n=cV=0.25×0.2=0.05mol,则Na2CO3•10H2O的质量=0.05×286=14.3g;
故答案为;14.3;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,则正确的操作顺序是BCAFED;
故答案为:BCAFED;
(3)A.所选用的溶质已经变质,部分已失去了结晶水,则溶质的质量偏大,溶液浓度偏高,A正确;
B.转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液的体积都不产生影响,对结果无影响,故B错误;
C.将未冷却的溶液沿玻璃棒注入容量瓶中,导致定容时加水的体积偏小,浓度偏高,故C正确;
D.定容时,仰视刻度线,溶液的体积偏大,浓度偏低,故D错误;
E.称量时误操作为“左码右物”,则溶质质量偏小,溶质的物质的量偏小,浓度偏低,故E错误;
F.定容后使溶液混匀静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线,导致体积偏大,浓度偏低,故F错误;
故选:AC;
(4)125mL0.2mol/LNa2CO3的物质的量为0.125L×0.2mol/L=0.025mol,125mL 0.3mol/L的硫酸的物质的量为0.125L×0.3mol/L=0.0375mol,则硫酸过量,碳酸钠完全反应生成二氧化碳,则生成二氧化碳0.025mol,标准状况下体积为0.025mol×22.4L/mol=0.56L=560mL,反应后溶液中钠离子物质的量为0.025mol×2=0.05mol,则钠离子的物质的量浓度=$\frac{0.05mol}{0.25L}$=0.2mol/L;
故答案为:560; 0.2mol/L.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,侧重考查学生实验能力和分析能力,注意误差分析的方法.


科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4在净水过程中能转变成氢氧化铁 | |
| B. | Na2FeO4能杀菌消毒 | |
| C. | Na2FeO4能除去水中的硫化氢等还原性气体杂质 | |
| D. | Na2FeO4能吸附水中的颜色和固体颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
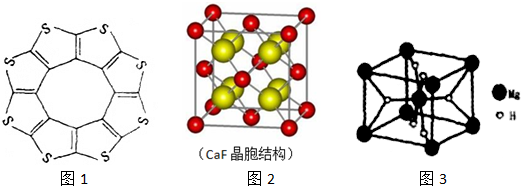
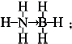 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
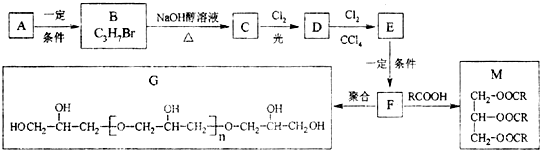
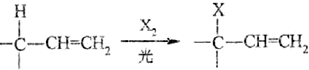
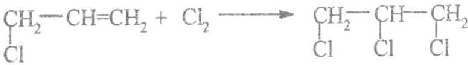 .
.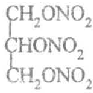 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠溶于水的反应:2Na+2H2O═2NaOH+H2↑ | |
| B. | 碳酸钠溶液和稀醋酸反应:CO2-3+2H+═H2O+CO2↑ | |
| C. | 向Ba(OH)2溶液中逐滴加入硫酸氢钠溶液至中性:2H++SO2-4+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 硫化亚铁中加入稀硝酸:FeS+2H+═Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
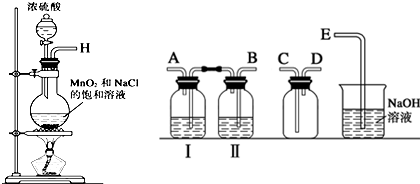
| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取少量上述漂白粉于试管中,先加入适量1mol•L-1盐酸溶解后,再把生成的气体通入新制澄清石灰水中. | 若澄清石灰水未见浑浊,则假设1成立; 若澄清石灰水变浑浊,则假设2或假设3成立. |
| 步骤2 | 已确定漂白粉变质,则另取少量上述漂白粉于试管中,先加入适量1mol•L-1 HCl溶液,再加入几滴品红溶液振荡. | 若品红溶液不褪色,则假设2成立; 若品红溶液褪色,则假设3成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B△H=+119kJ/mol,可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol | |
| D. | 在25℃、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则表示H2燃烧热的化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 热稳定性:Y的气态氢化物>Z的气态氢化物 | |
| B. | Z的最高价氧化物对应水化物的分子式为H2ZO4 | |
| C. | X元素的单质能与所有强酸发生反应放出H2 | |
| D. | R的核外电子数与OH-的核外电子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com