
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
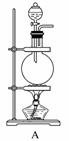
(1)采用装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2。
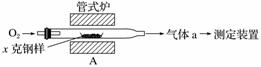
①气体a的成分是________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2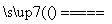
1________+3________。
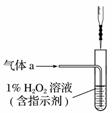
(2)将气体a通入测硫装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式
________________________________________________________________________
________________________________________________________________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:________。
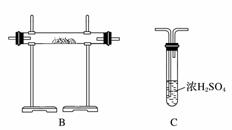
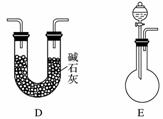
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
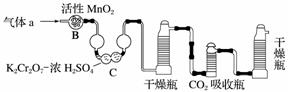
①气体a通过B和C的目的是__________________________________________。
②计算钢样中碳的质量分数,应测量的数据是________________________________
________________________________________________________________________。
解析 (1)①钢样(含有铁、碳、硫)在高温下与O2反应,除生成CO2、SO2外,还有剩余的O2,故气体a中含有CO2、SO2、O2。
②该反应中,S元素由-2价被氧化为+4价,即生成SO2,再结合元素守恒及元素的化合价升降总数相等,配平该反应方程式:3FeS+5O2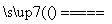 Fe3O4+3SO2。
Fe3O4+3SO2。
(2)①H2O2具有强氧化性,SO2具有强还原性,二者发生氧化还原反应生成H2SO4,化学方程式为H2O2+SO2===H2SO4。
②消耗1 mL NaOH溶液相当于硫的质量为y g,则消耗z mL NaOH溶液相当于硫的质量为yz g,那么钢样中硫的质量分数为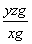 =
=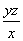 。
。
(3)①装置B中活性MnO2将SO2氧化。装置C中K2Cr2O7浓H2SO4具有强氧化性,用于吸收气体a中的SO2,防止SO2进入CO2吸收瓶,影响实验结果。
②实验中应测定实验前后CO2吸收瓶的质量变化,从而确定CO2的质量,继而求出钢样中碳的质量分数。
答案 (1)①SO2、CO2、O2 ②Fe3O4 SO2
(2)①H2O2+SO2===H2SO4 ②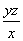
(3)①排除SO2对CO2测定的干扰 ②CO2吸收瓶吸收CO2前、后的质量


科目:高中化学 来源: 题型:
根据FeS2+O2—→Fe2O3+SO2,回答下列问题:
(1)氧化剂________,还原剂________,氧化产物________,还原产物________。
(2)元素化合价升高的元素为________,元素化合价降低的元素为________。
(3)1“分子”还原剂化合价升高总数为________,1“分子”氧化剂化合价降低总数为________。
(4)配平后各物质的系数依次为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
N2在诸多领域用途广泛。某化学兴趣小组为探究在实验室制备较为纯净N2的方法,进行了认真的准备。请你参与交流与讨论。
[查阅资料]N2的制法有下列三种方案:
方案1:加热NaNO2和NH4Cl的浓溶液制得N2。
方案2:加热条件下,以NH3还原CuO可制得N2,同时获得活性铜粉。
方案3:将空气缓缓通过灼热的铜粉获得较纯的N2。
[实验准备]以实验室常见仪器(药品)等设计的部分装置如下图(部分夹持和加热仪器未画出)。
[分析交流]
(1)若以方案1制得N2,应选择的发生装置是_____________________________。
(2)若按方案2制得干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料,整套制气装置按气流从左到右的连接顺序是______________(填字母)。获得N2的反应原理是________________________________________________________________________(写反应方程式)。
(3)若以排水法收集N2,其中会混入水蒸气。但也不宜用排空气法,其原因是________________________________________________________________________。
你提出的收集方法是________________________________________________________________________。
(4)上述三个方案中,制得的N2纯度最差的是________。在N2纯度要求不甚严格的情况下,有人建议将方案2和方案3结合使用,你认为其优点是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.分子中键的极性越强,分子越稳定
B.在分子中,化学键可能只有π键而没有σ键
C.分子中共价键的键能越大,键长越长,则分子越不稳定
D.若把H2S写成H3S,违背了共价键的饱和性
查看答案和解析>>
科目:高中化学 来源: 题型:
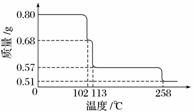
0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式________________________________________
________________________________________________________________________;
(要求写出推断过程)。
(2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为________________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为________,其存在的最高温度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
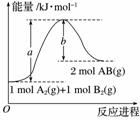
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com