
| A. | 1L 0.1mol•L-1氨水中的NH4+ | |
| B. | 0.1mol Na2O2 所含的阴离子 | |
| C. | 12.5mL 16 mol•L-1的浓硫酸能溶解的Cu | |
| D. | 18g H2O中含NA个质子 |
分析 A.一水合氨为弱电解质,在溶液中只能部分电离出铵根离子;
B.过氧化钠中的阴离子为过氧根离子,0.1mol过氧化钠中含有0.1mol过氧根离子;
C.浓硫酸变成稀硫酸后,稀硫酸不与铜反应;
D.水分子中含有10g质子,18g水的物质的量为1mol,含有10mol质子.
解答 解:A.1L 0.1mol•L-1氨水中含义0.1mol一水合氨,由于氨水为弱碱,只能部分电离,则溶液中含有的NH4+小于0.1mol,含有的铵根离子数目小于0.1NA,故A错误;
B.0.1mol Na2O2 中含有0.1mol过氧根离子,所含的阴离子数目为0.1NA,故B正确;
C.12.5mL 16 mol•L-1的浓硫酸中含有硫酸的物质的量为:16mol/L×0.0125L=0.2mol,由于稀硫酸不与铜反应,则硫酸不会完全反应,所以溶解的铜的物质的量小于0.1mol,故C错误;
D.18g水的物质的量为:$\frac{18g}{18g/mol}$=1mol,1mol水分子中含有10mol质子,含有的质子数为10NA,故D错误;
故选B.
点评 本题考查物质的量的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质都属于高分子化合物 | |
| B. | 淀粉、油脂和蛋白质都能发生水解反应 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 蛋白质既能与酸反应又能与碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定不含共价键 | |
| B. | 共价化合物中一定不含离子键 | |
| C. | 全部由非金属元素形成的化合物一定是共价化合物 | |
| D. | 金属元素和非金属元素之间形成的化学键一定是离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.如图是钒电池基本工作原理示意图:
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.如图是钒电池基本工作原理示意图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
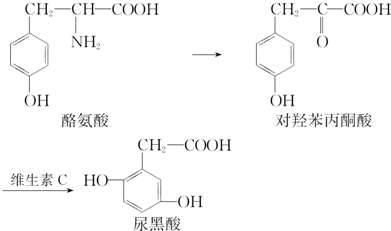
| A. | 酪氨酸既能与盐酸反应又能与NaOH溶液反应 | |
| B. | 对羟苯丙酮酸分子中有2种含氧官能团 | |
| C. | 1 mol尿黑酸最多可与含1 mol NaOH的溶液反应 | |
| D. | 可用溴水鉴别对羟苯丙酮酸与尿黑酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 大型飞机的发动机被誉为航空工业皇冠上的“宝石”.制造过程中通常采用碳化钨做关键部位的材料
大型飞机的发动机被誉为航空工业皇冠上的“宝石”.制造过程中通常采用碳化钨做关键部位的材料查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
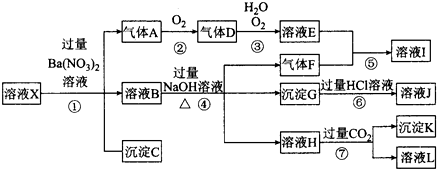
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com