
【题目】关于化学反应与能量,下列说法不正确的是
A. 化学电池可将电能转变为化学能
B. 化学反应一定伴随着能量变化
C. 燃料燃烧能将化学能转变为热能
D. 植物的光合作用将太阳能转化为化学能
科目:高中化学 来源: 题型:
【题目】下表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HC1O | H2CO3 |
KSp 或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10 -5 | Ka=3.0×10-8 | Ka1=4.1×10一7 Ka =5.6×10-11 |
A.相同浓度CH3COONa和Na2CO3的混合液中,各离子浓度的关系有:
c(Na+ )>c(CO32- )>c(CH3COO一)>c(OH-)>c(H+)
B.向0.1 mol/LCH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时 c(CH3COO) : c(CH3COO 一)=9 : 5
C.少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D.向浓度均为1×10-3mol/L的KC1和K2CrO4混合液中滴加1×10-3mol/L的AgNO3溶液,CrO42-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学欲配制100 mL 0.10 mol·L-1的CuSO4溶液。以下操作1~5是其配制的过程及示意图:
操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解。
操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中。
操作3:继续向X中加蒸馏水至液面离X的刻度线1~2 cm处。
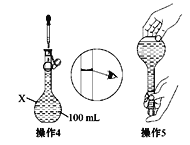
①仪器X的名称是________。称量过程中主要用到的仪器是_____________。在将烧杯中的溶液转移至容量瓶中,为了防止溶液溅出,应采取什么措施____________________。
②关于该配制过程,下列说法正确的是________。
A.操作1中,应称取胆矾晶体的质量为2.5 g
B.操作2中,洗涤液不需要转移到仪器X中
C.操作4称为定容,由于该同学的观察方法不正确,将导致所配溶液浓度偏低
D.操作5摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
(2)为实现金属钠在隔绝空气条件下与水反应并收集生成的气体,某研究性学习小组设计了如图发生装置。
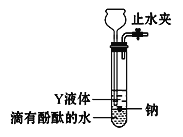
① Y液体可以选用________。
A.煤油 B.饱和的食盐水 C.四氯化碳
②实验前检验该装置气密性的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长时间运动引起机体缺氧时,血液pH的变化趋势、引起pH变化的物质、能起缓冲作用的物质分别是
A. 降低、CO2、H2CO3 B. 降低、乳酸、HCO3-
C. 升高、CO2、H2CO3 D. 升高、乳酸、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效碰撞是指 ( )
①反应物分子间的碰撞 ②反应物活化分子间的碰撞
③能发生化学反应的碰撞 ④反应物活化分子间有合适取向的碰撞
A. ① B. ② C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气,下列措施不能使氢气的生成速率增大的是
A、加热 B、不用稀硫酸,改用98%的浓硫酸
C、滴加少量CuSO4溶液 D、不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构、元素周期表和元素周期律,判断下列叙述不正确的是( )
A. 元素钇的一种核素![]() 的质子数与中子数之差为21
的质子数与中子数之差为21
B. 气态氢化物的稳定性:H2O>NH3>SiH4
C. 同主族元素从上到下,单质的熔点逐渐降低
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 能自发进行的反应都是放热反应
B. 凡是熵增加的反应一定能自发进行
C. 在一定条件下,吸热反应可以自发进行
D. 放热的熵增加的反应不一定能够自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3反应的化学方程式:_________________________________________。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+2SO![]() +4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
+4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①____SeO2+____I-+____H+===____Se+____I2+____H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程式①,并标出电子转移的方向和数目。_____________
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol·L-1的Na2S2O3溶液25.00 mL,所测样品中SeO2的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com