
| A. | 1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为2NA | |
| B. | 1LpH=2的NaHSO3溶液中,由水电离的H+数目为0.01 NA 个 | |
| C. | 1.5gCH3+里含有的电子数目为NA | |
| D. | 62g白磷中含有P_P键的数目为3NA |
分析 A、钠和氧气反应后变为+1价;
B、pH=2的NaHSO3溶液中,HSO3-的电离大于水解;
C、求出CH3+的物质的量,然后根据1molCH3+中含8mol电子来分析;
D、求出白磷P4的物质的量,然后根据1mol白磷中含6molP-P键来分析.
解答 解:A、钠和氧气反应后变为+1价,故1mol钠完全反应转移1mol电子即NA个,而生成的产物无论是氧化钠还是过氧化钠,均是2molNa+~1mol阴离子,而1mol钠反应后变为1molNa+,故所对应的阴离子的物质的量为0.5mol,即产物中离子共1.5NA个,故A错误;
B、pH=2的NaHSO3溶液中,HSO3-的电离大于水解,故溶液中的氢离子主要来自于HSO3-的电离,故溶液中水电离出的氢离子小于0.01NA个,故B错误;
C、1.5gCH3+的物质的量为0.1mol,而1molCH3+中含8mol电子,故0.1mol中含0.8mol电子即0.8NA个,故C错误;
D、62g白磷P4的物质的量为n=$\frac{62g}{124g/mol}$=0.5mol,而1mol白磷中含6molP-P键,故0.5mol白磷中含3molP-P键即3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 容量瓶中原有少量蒸馏水 | B. | 溶解所用的烧杯未洗涤 | ||
| C. | 定容时仰视观察液面 | D. | 定容时俯视观察液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验亚硫酸钠是否变质 | 先将亚酸钠样品溶于水配成溶液,然后加入足量稀盐酸酸化,再加入Ba(NO3)2溶液观察是否生成白色沉淀观察是否产生白色沉淀 |
| B | 除去苯中混有的苯酚 | 加入适量的溴水充分反应后过滤弃去沉淀 |
| C | 除去NaCl晶体中少量的KNO3杂质 | 先将晶体溶于水配成溶液,然后蒸发结晶并趁热过滤弃去滤液 |
| D | 检验CH3CH2Br中存在的溴元素 | 将CH3CH2Br与NaOH溶液共热,冷却后,取出上层水溶液,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D四种短周期元素的核电荷数依次增大.A原子s轨道电子数是p轨道电子数的两倍,C原子的L能层中有两对成对电子,C、D同主族. E、F是第四周期元素,且E位于周期表中ds区,F原子核外有33种不同运动状态的电子.根据以上信息用相应的元素符号填空:
已知A、B、C、D四种短周期元素的核电荷数依次增大.A原子s轨道电子数是p轨道电子数的两倍,C原子的L能层中有两对成对电子,C、D同主族. E、F是第四周期元素,且E位于周期表中ds区,F原子核外有33种不同运动状态的电子.根据以上信息用相应的元素符号填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
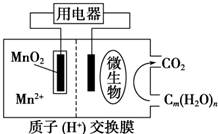
| A. | 正极反应式为MnO2+4H++2e-═Mn2++2H2O | |
| B. | 微生物所在电极区放电时发生还原反应 | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若用该电池给铅蓄电池充电,MnO2 电极质量减少8.7g,则铅蓄电池阴极增重9.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应一段时间后,乙装置中生成的氢氧化钠在铁极区 | |
| B. | 乙装置中铁电极为阴极,电极反应式为Fe-2e -=Fe2+ | |
| C. | 通入氧气的一极为正极,发生的电极反应为O2-4e -+2H2O═4OH- | |
| D. | 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X的一个分子中有32个氢原子 | B. | X的一个分子中含有三个 | ||
| C. | X是一种醇 | D. | X不能使溴的CCl4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com