
| A. | NH3 | B. | O3 | C. | CO2 | D. | BeCl2 |
分析 中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此判断.
解答 解:A.NH3分子中氮原子价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4,所以N原子采用sp3杂化,故A正确;
B.O3分子中氧原子价层电子对个数=2+$\frac{1}{2}$×(6-2×2)=3,所以O原子采用sp2杂化,故B错误;
C.CO2分子中碳原子价层电子对个数=2+$\frac{1}{2}$×(4-2×2)=2,所以C原子采用sp杂化,故C错误;
D.BeCl2中铍原子价层电子对个数=2+$\frac{1}{2}$×(2-1×2)=2,所以Be原子采用sp杂化,故D错误;
故选A.
点评 本题考查了原子杂化方式的判断,根据价层电子对互斥理论来分析解答即可,明确孤电子对个数=$\frac{1}{2}$(a-xb)中各个字母的含义,题目难度中等.


科目:高中化学 来源: 题型:解答题
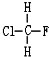 与
与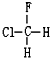 B.
B. 与
与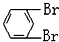 C.
C.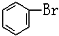 与
与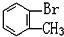 D.
D.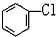 与
与 E.ClC(CH3)3与(CH3)2CHCH2Cl F.
E.ClC(CH3)3与(CH3)2CHCH2Cl F.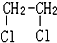 与CH3-CH2Cl
与CH3-CH2Cl 由一种单体脱水缩聚而成的,该单体的键线式为
由一种单体脱水缩聚而成的,该单体的键线式为
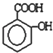 )滴入Na2CO3溶液中,生成的有机物的结构简式是:
)滴入Na2CO3溶液中,生成的有机物的结构简式是: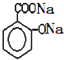
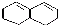 在较高温度下和Br2按物质的量之比1:1发生1,4-加成反应的化学方程式
在较高温度下和Br2按物质的量之比1:1发生1,4-加成反应的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
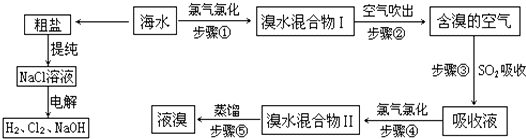
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研究化学反应中的能量变化,有利于通过改变反应条件,使同一反应消耗相同量的物质而放出更多的热,提高化学能的利用率 | |
| B. | 任何放热的化学反应,均可以利用原电池直接把化学能转化为电能 | |
| C. | 研究化学反应速率与化学平衡,有利于指导实际生产中达到“多,快,好,省”的生产效率 | |
| D. | 使用催化剂常常可以加快化学反应速率,但不能提高反应物的转化率,因此在实际生产中较少使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、氯酸钾、氧化钠分别属于酸、碱、盐、碱性氧化物 | |
| B. | 将饱和FeCl3溶液滴入NaOH溶液中,加热煮沸,可制得Fe(OH)3胶体 | |
| C. | 反应8NH3+3Cl2═N2+6NH4Cl中,氧化剂与还原剂物质的量之比是3:2 | |
| D. | 氯气的水溶液能导电,因此氯气属于电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com