
| A. | 它是烃的衍生物 | B. | 它是含有三种元素的混合物 | ||
| C. | 它的相对分子质量为32 | D. | 它在空气中燃烧只生成CO2 |
科目:高中化学 来源: 题型:选择题
| A. | 甲同学认为氯化铵由N、H、Cl三种元素组成 | |
| B. | 乙同学认为一个氯化铵分子中含有一个NH4+和一个Cl- | |
| C. | 丙同学认为氯化铵由NH4+和Cl-构成 | |
| D. | 丁同学认为氯化铵中阴、阳离子个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 ,①、②、③原子半径从大到小的顺序是①②③
,①、②、③原子半径从大到小的顺序是①②③查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | B. | 2Na2O2+2CO2=2Na2CO3+O2 | ||
| C. | 2NaOH+Cl2=NaCl+NaClO+H2O | D. | NH3+CO2+H2O=NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有共价键 | |
| B. | 共价化合物中可能含有离子键 | |
| C. | 第IA族元素与第VIIA族可能形成离子化合物,也可能形成共价化合物 | |
| D. | 非金属元素间不可能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
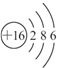 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氖元素的相对原子质量一定是12a/b | |
| B. | W g该氖原子的物质的量一定是W/(aNA)mol | |
| C. | 该氖原子的摩尔质量是aNA g | |
| D. | W g该氖原子所含的质子数是10 W/(aNA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
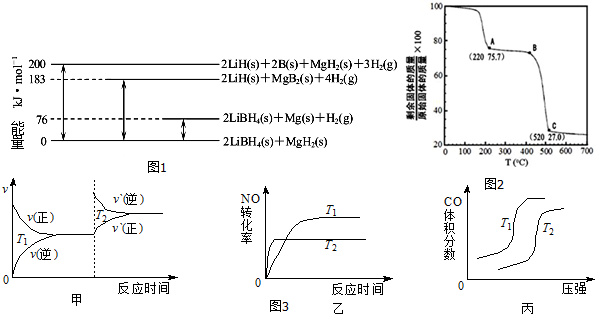
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com