
分析 (1)N4气体转变为N2气体先破坏N4分子N-N键吸收能量,再生成N2分子形成N≡N键放出能量,注意一个N4分子中含有6个N-N键,根据能量的变化写出热化学反应方程式;
(2)根据三段式计算出各组分的物质的量的变化量、平衡时各组分的物质的量;
①平衡常数指生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比值,即k=$\frac{c{({O}_{2})×c}^{4}(N{O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$;根据体积分数等于氧气物质的量除以混合气体总物质的量计算O2的体积分数;
②根据v=$\frac{△c}{△t}$计算v(O2);
③该反应为吸热反应,降低温度平衡向逆反应进行,再根据选项具体分析;
(3)平衡后分别再充入NO2和再充入N2O4,相当于增大体系压强,二氧化氮平衡转化率增大,平衡时N2O4与NO2的物质的量之比为a增大.
解答 解:(1)根据原子守恒知,一个N4分子生成2个N2分子,一个N4分子中含有6个N-N键,破坏1molN4分子中含有6molN-N键需要吸收167kJ/mol×6mol=1002kJ能量;生成2molN≡N键放出942kJ/mol×2mol=1884kJ能量,所以该反应放出1884kJ-1002kJ=882kJ能量,所以热化学反应方程式为N4(g)=2N2(g)△H=-882kJ/mol,
故答案为:N4(g)=2N2(g)△H=-882kJ/mol;
(2)令平衡时O2的物质的量为nmol,则
对于反应 2N2O5(g)?4NO2(g)+O2(g),
开始(mol):5 0 0
变化(mol):2n 4n n
平衡(mol):5-2n 4n n
所以$\frac{4n}{(5-2n)+4n+n}$×100%=50%,解得n=1,
①由上述计算知平衡时N2O53mol、NO24mol、O21mol.所以平衡时N2O5的浓度为$\frac{3mol}{10L}$=0.3mol/L,平衡时NO2的浓度为$\frac{4mol}{10L}$=0.4mol/L,平衡时O2的浓度为$\frac{1mol}{10L}$=0.1mol/L,
所以平衡常数k=$\frac{c{({O}_{2})×c}^{4}(N{O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$=$\frac{0.1×0.{4}^{4}}{0.{3}^{2}}$,
平衡时O2的物质的量为NO2的$\frac{1}{4}$,所以O2的体积分数也为NO2的体积分数的$\frac{1}{4}$,
所以O2的体积分数为$\frac{1}{4}$×50%=12.5%,
故答案为:$\frac{0.1×0.{4}^{4}}{0.{3}^{2}}$;12.5%;
②由上述计算知平衡时O2的质的量为1mol,
从0~5min内用O2表示该反应的平均速率v(O2)=$\frac{\frac{1mol}{10L}}{5min}$=0.02mol/(L•min),
故答案为:0.02mol/(L•min);
③A.该反应正反应为吸热反应,降低温度平衡向逆反应进行,由于反应前气体体积比反应后小,所以压强减小,故A正确;
B.都为气体,总质量不变,体积不变,所以密度不变,故B错误;
C.温度降低,反应速率降低,故C正确;
D.该反应正反应为吸热反应,降低温度平衡向逆反应进行,N2O5的浓度增加,故D错误;
故选:AC;
(3)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g)?N2O4(g),平衡后分别再充入NO2和再充入N2O4,相当于增大体系压强,二氧化氮平衡转化率增大,平衡时N2O4与NO2的物质的量之比为a增大;
故答案为:B.
点评 本题考查了反应热、原电池电极反应、平衡常数反应速率的影响因素分析判断,化学平衡移动、化学平衡常数及计算等,难度中等,考查学生分析和解决问题的能力和对知识的掌握.


科目:高中化学 来源:2016-2017学年吉林省长春市高一上学期期初考试化学试卷 题型:选择题
NaHS、MgSO4、NaHSO4三种物质组成的混合物中,已知氧元素的质量分数为a%,则其中硫元素的质量分数为
A.a%
B.1-1.75%
C.4(1-a%)/7
D.3(1-a%)/7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高二上学期期初考试化学试卷 题型:选择题
25℃CaCO3固体溶于水达饱和时物质的量浓度是9.327×10-5mol/L,则CaCO3在该温度下的Ksp为
A.9.3×10-5mol/L
B.9.7×10-9mol2/L2
C.7.6×10-17mol4/L4
D.8.7×10-9mol2/L2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L | B. | 3.36 L | C. | 4.48 L | D. | 6.72 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
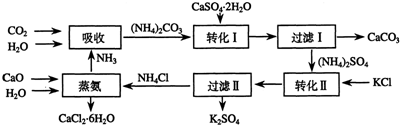
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a:b | B. | a:2b | C. | a:2(a+b) | D. | a:(a+2b) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、HCl | B. | NH3、CO、HCl | C. | CH4、NH3、CO | D. | CH4、H2、CO、CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com