
| A. | 使用分液漏斗和容量瓶时,首先要查仪器是否漏液 | |
| B. | 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体发生暴沸 | |
| C. | 将浓硫酸倒入盛水的量筒中稀释成稀硫酸 | |
| D. | 用蒸发皿进行加热蒸发时,不需垫石棉网可直接进行加热 |
分析 A.具有塞子、活塞的仪器需要检查漏液;
B.加入几粒沸石或碎瓷片,可防止液体剧烈沸腾;
C.量筒中不能稀释溶液;
D.蒸发皿直接加热.
解答 解:A.使用分液漏斗和容量瓶时,首先要查仪器是否漏液,若漏液,仪器不能使用,故A正确;
B.蒸馏实验中,从实验安全角度考虑,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体发生暴沸,故B正确;
C.不能在量筒中稀释,应在烧杯中稀释,故C错误;
D.蒸发皿为常见的直接加热仪器,用蒸发皿进行加热蒸发时,不需垫石棉网可直接进行加热,故D正确;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握常见仪器的使用、实验基本操作等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
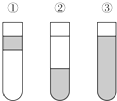 在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示的现象,正确的结论是( )
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示的现象,正确的结论是( )| A. | ①加CCl4 ②加苯 ③加酒清 | B. | ①加酒精 ②加CCl4 ③加苯 | ||
| C. | ①加苯 ②加CCl4 ③加酒精 | D. | ①加苯 ②加酒精 ③加CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 取含HCl和MgSO4的混合溶液1L,逐滴加入1mol•L-1的Ba(OH)2溶液,如图为产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图:
取含HCl和MgSO4的混合溶液1L,逐滴加入1mol•L-1的Ba(OH)2溶液,如图为产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44g CO2所含的原子数目约为3NA | |
| B. | 2.3g钠在空气中氧化成Na2O转移电子数为0.2NA | |
| C. | 在标准状况时,22.4L CCl4所含的原子数为5NA | |
| D. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 钠与水的反应 Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铜片插入硝酸银溶液 Cu+Ag+=Cu2++Ag | |
| D. | 大理石溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com