
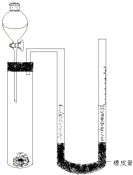
 �ڻ�ѧ�о���������Ҫ��һЩ���ʽ������ʵ�ȷ��������������װ�ã��г���������ȥ�����һ������þ�����ᷴӦ�ų�������������Խ���þ�����ԭ���������вⶨ��ʵ�鲽�����£�
�ڻ�ѧ�о���������Ҫ��һЩ���ʽ������ʵ�ȷ��������������װ�ã��г���������ȥ�����һ������þ�����ᷴӦ�ų�������������Խ���þ�����ԭ���������вⶨ��ʵ�鲽�����£����� ��1�������������������U���ڵ�Һ�����ɵ�ѹǿ���ʹ���屻ѹ����
��2�����������֪��mgþ��Ӧ���ɵ����������Ϊ��V2-V1��mL���Ӷ�����������������ʵ�����Ȼ�����1molMg��1molH2���Ӷ��������mgþ�����ʵ������̶��ܱ�ʾ��þ�����ԭ������Ar��Mg������������ļ������ų�һ�������壬�����ռ��������������ƫ��
��3������þ���ܶȱȽ�С����������ҷ�Ӧʱ���Ӵ�����������ͭ����������ȷ��þ����������Һ���ڲ����Ӷ�þȫ�������ᷴӦ��
��� �⣺��1��þ������ķ�ӦΪ���ȷ�Ӧ���ʷ�Ӧ���ɵ�������ʼʱ�¶�ƫ�ߣ������ƫ����u���ڵ�Һ�����ɵ�ѹǿ���ʹ���屻ѹ������Ӧ��װ����ȴ�����º������µ����ұ߲����ܵĸ߶ȣ�ʹ���˹���Һ����ͬһˮƽ����ٶ�����
�ʴ�Ϊ����װ����ȴ�����º������µ����ұ߲����ܵĸ߶ȣ�ʹ���˹���Һ����ͬһˮƽ�棻
��2�����������֪��mgþ��Ӧ���ɵ����������Ϊ��V2-V1��mL�������������ʵ���Ϊn=$\frac{��{V}_{2}-{V}_{1}��mL��1{0}^{-3}L/mL}{22.4L/mol}$=$\frac{{V}_{2}-{V}_{1}}{22400}$mol����þ�����ᷴӦʱ1molMg��1molH2���ʿ�֪mgþ�����ʵ���n=$\frac{{V}_{2}-{V}_{1}}{22400}$mol����Ħ������M=$\frac{m}{n}$=$\frac{mg}{\frac{{V}_{2}-{V}_{1}}{22400}mol}$=$\frac{22400m}{{V}_{2}-{V}_{1}}$g/mol����þ�����ԭ����������ֵAr��Mg��=$\frac{22400m}{{V}_{2}-{V}_{1}}$����������ļ������ų�һ�������壬�����ռ��������������ƫ�ʱ���ʽ��ȷ���ʴ�Ϊ��$\frac{22400m}{{V}_{2}-{V}_{1}}$�����������Թ��е���������Ҳ�����˲�������������У�
��3������þ���ܶȱȽ�С����������ҷ�Ӧʱ���Ӵ�����������������������ͭ����������ȷ��þ����������Һ���ڲ����Ӷ�ȷ��þȫ�������ᷴӦ����������
�ʴ�Ϊ����þ����û�������У���ֹþ��������Ӧ��ʹþȫ����������������
���� ���⿼��ʵ��̽����Ϊ��Ƶ���㣬���ؿ���ѧ��ʵ�������ʵ����������ۣ���ȷʵ��ԭ�������������ǽⱾ��ؼ���ע����������Ϊ�״��⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ��ɫ���ֲ��䣬˵���������淴Ӧ�ﵽƽ��״̬ | |
| B�� | �����̷���FeSO4•7H2O����M=278������ԭ��������1L��ˮ��������Ҫ917.4 g | |
| C�� | ������ת����Ӧ��ƽ�ⳣ��K=l04����ת����������Һ��pH=1 | |
| D�� | ������Ksp[Cr��OH��3]=1��10-32��Ҫʹ�������ˮ�е�c��Cr3+ ������1��10-5mol/L��Ӧ����Һ��pH=5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
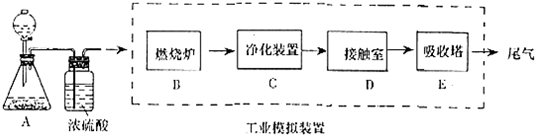

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������Ԫ�ص���������ϼ۵����������������� | |
| B�� | ������������۵�������ͬ | |
| C�� | �ǽ���Ԫ���ڻ������мȿ��������ֿ��Ը��� | |
| D�� | ���зǽ���Ԫ�صĸ����ϼ۵���ʹԭ�Ӵﵽ8�����ȶ��ṹ����õ��ĵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
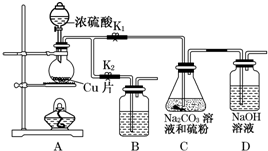
| ��� | 1 | 2 | 3 | 4 |
| ��Һ�����/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| ����I2����Һ�����/mL | 19.99 | 19.98 | 17.13 | 20.03 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
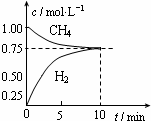 ��ҵ���Ʊ��ϳ����Ĺ�����Ҫ��ˮ�����������飺CH4��g��+H2O��g��?CO��g��+3H2��g������H=+206kJ/mol��һ�������������Ϊ1L���ܱ������г���1mol CH4��1mol H2O�����CH4��g����CO��g����Ũ����ʱ��仯������ͼ��ʾ������˵����ȷ���ǣ�������
��ҵ���Ʊ��ϳ����Ĺ�����Ҫ��ˮ�����������飺CH4��g��+H2O��g��?CO��g��+3H2��g������H=+206kJ/mol��һ�������������Ϊ1L���ܱ������г���1mol CH4��1mol H2O�����CH4��g����CO��g����Ũ����ʱ��仯������ͼ��ʾ������˵����ȷ���ǣ�������| A�� | 10minʱ��CH4��ʾ�ķ�Ӧ����Ϊ0.075 mol•L-1•min-1 | |
| B�� | ʹ�ø�Ч�����ܹ�����CO�IJ��� | |
| C�� | �������·�Ӧ��ƽ�ⳣ��Ϊ0.1875 | |
| D�� | �����¶���ʹ$\frac{c��C{H}_{4}��}{c��CO��}$���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͭм����Fe3+��Һ�У�2Fe3++Cu�T2Fe2++Cu2+ | |
| B�� | �������������������Fe3O4+8H+�T3Fe3++4H2O | |
| C�� | �Ȼ�������Һ��ͨ��������Fe2++Cl2�TFe3++2Cl- | |
| D�� | �����ۼ���ϡ�����У�2Fe+6H+�T2Fe3++3H2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com