
分析 (1)0.1mol•L-1CH3COONa溶液中醋酸根离子水解溶液显碱性,醋酸根离子水解生成醋酸和氢氧根离子;
(2)碳酸钠为强碱弱酸盐,在溶液中存在水解平衡,从平衡移动的角度分析并解答该题;
(3)NaHCO3与Al2(SO4)3发生相互促进的水解反应生成二氧化碳和氢氧化铝;
(4)0.1mol•L-1NaHCO3溶液的pH大于8,说明碳酸氢根离子的水解程度大于电离程度;
(5)ZnCl2•xH2O易溶于水,且其水溶液呈酸性,氯化锌水解生成氢氧化锌和盐酸,溶液显酸性,SOCl2极易与水发生生成二氧化硫和盐酸,其中盐酸起到抑制氯化锌的水解,晶体和SOCl2混合加热,结晶水失去和SOCl2极易和水反应生成盐酸和二氧化硫.
解答 解:(1)0.1mol•L-1CH3COONa溶液中醋酸根离子水解溶液显碱性,醋酸根离子水解生成醋酸和氢氧根离子,反应的离子方程式:CH3COO-+H2O=CH3COOH+OH-,
故答案为:碱,CH3COO-+H2O=CH3COOH+OH-;
(2)碳酸钠为强碱弱酸盐,在溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,为了防止发生水解,可以加入少量NaOH或NaHCO3,使平衡向逆反应方向移动,从而抑制水解,
故答案为:NaOH (或NaHCO3);
(3)NaHCO3与Al2(SO4)3发生相互促进的水解反应生成二氧化碳和氢氧化铝,其反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)常温下,0.1mol•L-1NaHCO3溶液中存在电离和水解,离子方程式为:HCO3-?CO32-+H+、HCO3-+H20?H2CO3+OH-,的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),
故答案为:>;HCO3-?CO32-+H+、HCO3-+H20?H2CO3+OH-,HCO3-的水解程度大于电离程度;
(5)ZnCl2•xH2O易溶于水,且其水溶液呈酸性,氯化锌水解生成氢氧化锌和盐酸,溶液显酸性,SOCl2极易与水发生生成二氧化硫和盐酸,其中盐酸起到抑制氯化锌的水解,晶体和SOCl2混合加热,反应的化学方程式为:ZnCl2•XH2O+XSOCl2 $\frac{\underline{\;\;△\;\;}}{\;}$ZnCl2+XSO2+2XHCl,结晶水失去和SOCl2极易和水反应生成盐酸和二氧化硫,
SOCl2的作用是夺取ZnCl2•XH2O中的结晶水,生成的HCl抑制ZnCl2•XH2O的水解,
故答案为:ZnCl2•XH2O+XSOCl2 $\frac{\underline{\;\;△\;\;}}{\;}$ZnCl2+XSO2+2XHCl;夺取ZnCl2•XH2O中的结晶水,生成的HCl抑制ZnCl2•XH2O的水解.
点评 本题考查了盐类水解的原理分析判断,溶液酸碱性比较,弱离子的性质应用,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
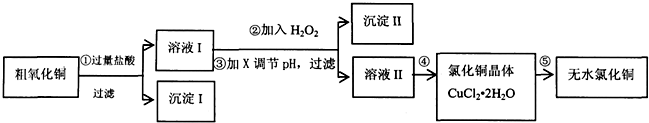
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
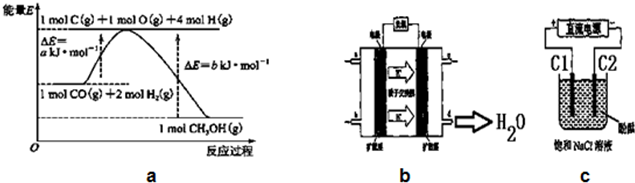
| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的 2 mol/L的硫酸于试管 | 反应速率:镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com