
分析 (1)应用硫酸与蒸馏水进行进行沉淀洗涤;将混合体系静置,取上层清液少许滴入稀硫酸,如果出现白色沉淀,说明沉淀未完全;
(2)具体方法是取最后一次水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净;
(3)根据硫酸钡质量计算氯化钡质量,进而计算水的质量,根据二者质量之比确定x的值;
(4)部分沉淀被滤纸中的碳还原为BaS,单质固体硫酸钡的质量偏小,测定氯化钡的质量偏小,水的质量偏大.
解答 解:(1)将混合体系静置,取上层清液少许滴入稀硫酸,如果出现白色沉淀,说明沉淀未完全,故答案为:混合体系静置,取上层清液少许滴入稀硫酸,如果不出现白色沉淀,说明沉淀完全;
(2)应用硫酸与蒸馏水进行进行沉淀洗涤,具体方法是取最后一次水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净;
,故答案为:蒸馏水;取最后一次水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净;
(3)沉淀1.165g为硫酸钡质量,其物质的量=$\frac{1.165g}{233g/mol}$=0.005mol,故氯化钡晶体中氯化钡的质量=0.005mol×208g/mol=1.04g,含有结晶水的质量=1.222g-1.04g=0.182g,则208:18x=1.04g:0.182g,解得x≈2,故答案为:2;
(4)部分沉淀被滤纸中的碳还原为BaS,单质固体硫酸钡的质量偏小,测定氯化钡的质量偏小,水的质量偏大,故x的值偏高,
故答案为:偏高.
点评 本题考查物质组成的测定,分子式的确定是难点,需要学生具备扎实的基础,难度中等.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=40.69 kJ•mol-1 | |||||||||||
| B. | Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be | |||||||||||
| C. | 已知:
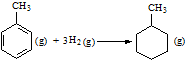 的△H为-384 kJ•mol-1 的△H为-384 kJ•mol-1 | |||||||||||
| D. | 固体NH5的所有原子的最外层均满足2个或8个电子的稳定结构,它与水反应的化学方程式为NH5+H2O═NH3•H2O+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.1 mol•L-1的NH4Cl和0.1 mol•L-1的NH3•H2O等体积混合后溶液中的离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量盐酸使溶液的pH=7,则混合溶液中,离子浓度关系:c (Na+)=c (CH3COO-) | |
| D. | 0.1 mol•L-1的NaHS溶液中离子浓度关系:c (OH-)=c (H+)-c (S2-)+c (H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过浓硫酸除去HCl中的H2O | |
| B. | 通过灼热的CuO除去H2中的CO | |
| C. | 通过灼热的镁粉除去CO2中的N2 | |
| D. | 通过饱和碳酸氢钠溶液除去Cl2中的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红的溶液中:Na+、AlO2-、SO42-、Cl- | |
| B. | 含大量OH-的溶液中:HCO3-、Na+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 0.1mol/L NaAlO2溶液:H+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol | B. | $\frac{5}{3}$mol | C. | $\frac{5}{6}$mol | D. | $\frac{2}{5}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com