
 Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )| A. | 可用如下方法除去污水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+(aq) | |
| B. | 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在 | |
| C. | HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl- | |
| D. | 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2 |
分析 A.据沉淀的转化原理分析;
B.当c(C1-)=10-1 mol/L即pCl=1时,根据图象分析;
C.HgCl2是一种弱电解质,根据溶液中离子存在方式判断电解质电离方式;
D.根据图象可知当溶液pH保持在5,pCl由2改变至6时,根据图片中微粒存在方式判断;
解答 解:A.HgS比FeS更难溶于水,所以在含有Hg2+的溶液中加入FeS,能够将Hg2+除掉,故A正确;
B.当c(C1-)=10-1 mol/L即pCl=1时,汞元素主要是以HgCl42-形式存在,故B正确;
C.HgCl2是一种弱电解质,其电离方程式是:2HgCl2?HgCl++HgCl3ˉ,故C错误;
D.根据图象可知当溶液pH保持在5,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2,故D正确;
故选C.
点评 本题考查了溶解平衡的有关应用与判断等知识点,正确分析图象中曲线变化是解本题关键,再结合外界条件对平衡的影响等知识点来分析解答,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )| A. | 电池放电时Na+从a极区移向b极区 | |
| B. | 电极b采用MnO2,MnO2既作电极材料又有还原作用 | |
| C. | 该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O | |
| D. | 每消耗3 mol H2O2,转移的电子为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>0 | B. | △H2>0 | C. | △H2<△H3 | D. | △H5=2△H4+△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
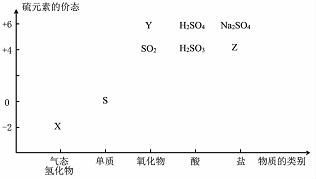 物质的类别和核心元素的化合价是研究物质性质的两个基本视角?
物质的类别和核心元素的化合价是研究物质性质的两个基本视角? ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱 (填“强”或“弱”)?用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱?
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱 (填“强”或“弱”)?用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱?| 溶解度(s)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3对 | B. | 4对 | C. | 5对 | D. | 6对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.05 mol•L-1 Fe2(SO4)3溶液中含Fe3+数目为0.1NA | |
| B. | 标准状况下,22.4 L甲苯中含C-H数目为8NA | |
| C. | 常温常压下,3.2 g O2和O3混合物中,氧原子的数目为0.2NA | |
| D. | 0.1 mol Na2O2与足量CO2反应时,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有12个质子的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com