
对下列化学用语的理解正确的是( )
A.离子结构示意图 既可以表示35Cl-,也可以表示37Cl-
既可以表示35Cl-,也可以表示37Cl-
B.电子式 既可以表示羟基,也可以表示氢氧根离子
既可以表示羟基,也可以表示氢氧根离子
C.比例模型 既可以表示甲烷分子,也可以表示四氯化碳分子
既可以表示甲烷分子,也可以表示四氯化碳分子
D.结构简式(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷
科目:高中化学 来源:2014年化学高考题型专练十 电解质溶液中微粒浓度的关系练习卷(解析版) 题型:选择题
常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是 ( )。

A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32—)+c(HCO3—)+
c(OH-)
B.当溶液的pH为7时,溶液的总体积为20 mL
C.在B点所示的溶液中,浓度最大的阳离子是Na+
D.在A点所示的溶液中:c(CO32—)=c(HCO3—)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练三 特定条件下离子方程式的书写与判断练习卷(解析版) 题型:选择题
下列所述事实与化学(或离子)方程式不相符的是 ( )。
A.能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O
B.能说明NH3结合H+能力比H2O强:NH3+H3O+=NH4++H2O
C.能说明盐酸是强酸:2HCl+CaCO3=CaCl2+CO2↑+H2O
D.能说明CH3COOH是弱电解质:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练10甲烷乙烯苯煤石油天然气的综合利用练习卷(解析版) 题型:填空题
下表是A、B、C、D、E五种有机物的有关信息:
A①能使溴的四氯化碳溶液褪色;
②比例模型为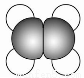
③能与水在一定条件下反应生成C
B①由C、H两种元素组成。
②球棍模型为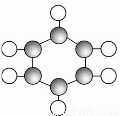
C①由C、H、O三种元素组成;
②能与Na反应;
③与E反应生成相对分子质量为88的酯
D①相对分子质量比C少2;
②能由C催化氧化得到
E①由C、H、O三种元素组成;
②其水溶液能使紫色石蕊试液变红
回答下列问题:
(1)A~E中,属于烃的是___________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为_______________。
(3)C催化氧化生成D的化学方程式为_________________________________。
(4)有机物B具有的性质是__________ (填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是________________________(用化学方程式说明)。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练10甲烷乙烯苯煤石油天然气的综合利用练习卷(解析版) 题型:选择题
下列有关聚乙烯的说法正确的是( )
A.聚乙烯是通过加聚反应生成的
B.聚乙烯具有固定的元素组成,因而具有固定的熔、沸点
C.聚乙烯塑料袋因有毒,不可以装食品
D.聚乙烯因性质稳定,故不易造成污染
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练 7-3化学平衡常数化学反应进行方向练习卷(解析版) 题型:选择题
已知:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol 某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol 某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:

下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6 mol/L
③平衡时,反应混合物的总能量减少20 kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08 mol·L-1
A.①②④⑤ B.②⑥
C.②③④⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练 7-3化学平衡常数化学反应进行方向练习卷(解析版) 题型:选择题
某温度下,可逆反应mA(g)+nB(g) pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
A.K越大,达到平衡时,反应进行的程度越大
B.K随着温度的升高而增大
C.K越小,达到平衡时,反应物的转化率越大
D.K随反应物浓度的改变而改变
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练3-4金属材料用途 金属矿物利用练习卷(解析版) 题型:填空题
以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料进行炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:

已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
(1)试剂a是__________,试剂b是__________。
(2)操作X应为蒸发浓缩、__________、__________。
(3)反应Ⅱ中加CuO调pH为__________,目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀。
(4)反应Ⅴ的离子方程式为:__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-3盐类的水解练习卷(解析版) 题型:选择题
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com