
| A、所含质子数为(A-n) |
| B、所含中子数为(A-Z) |
| C、所含电子数为(Z+n) |
| D、该粒子比M原子多n个电子 |


科目:高中化学 来源: 题型:
| A、H+、Ag+、NO3-、Cl- |
| B、K+、Na+、NO3-、Cl- |
| C、NH4+、H+、SO42-、OH- |
| D、Ca2+、K+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
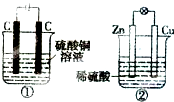 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积:①=② |
| B、溶液的pH变化:①减小,②增大 |
| C、电极反应式:①中阳极为4 OH--4e-=2H2O+O2↑②中负极为2H++2e-=H2↑ |
| D、①中阴极质量增加,②中正极质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠投入水中:2Na2O2+2H2O═4Na++4OH-+O2↑ |
| B、二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O |
| C、碳酸钙溶于盐酸:CO32-+2H+═H2O+CO2↑ |
| D、向氯化亚铁溶液中滴入氯水:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 |
| B、形成酸雨的主要物质是硫的氧化物和氮的氧化物 |
| C、从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg |
| D、水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
| B、等物质的量浓度、等体积的Na2S与KHSO3溶液混合c (Na+)>c(K+)>c(SO32-)>c(HS-)>c(OH-)>c((H+) |
| C、在0.1mol?L-1NaHSO3溶液中有c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) |
| D、pH<7的某二元弱酸的酸式盐NaHA溶液中有c(H+)+2c(A2-)═c(OH-)+c(H2A) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com