


科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| [H2]?[CO2] |
| [CO]?[H2O] |
| [H2]?[CO2] |
| [CO]?[H2O] |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
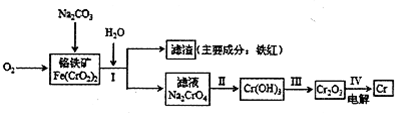
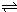 Cr2O72-+H2O
Cr2O72-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | |||||||
| X | 578 | 1817 | 2745 | 11575 | 14830 | 18376 | 23293 |
| Y | 738 | 1451 | 7733 | 10540 | 13630 | 17995 | 21703 |
| Z | 496 | 4562 | 6912 | 9943 | 13353 | 16610 | 20114 |
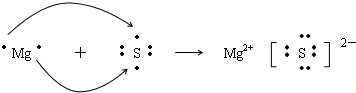

查看答案和解析>>
科目:高中化学 来源: 题型:
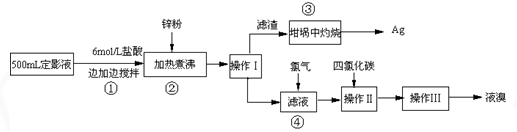

查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.
Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com