
【化学─选修2:化学与技术】(15分)硫酸工业的废渣回收再利用的工艺流程如下:
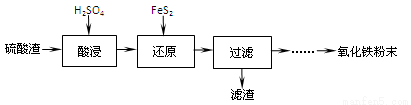
注:硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。“酸浸”后Fe2+可被空气中O2氧化(用离子反应方程式表示) 。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
第一步:氧化: ;(填写具体操作)
第二步:沉淀 ;(填写具体操作)
第三步:分离,洗涤;
第四步:烘干,研磨。
科目:高中化学 来源:2014-2015学年四川省高三下学期第二次月考化学试卷(解析版) 题型:选择题
向下图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。X和Y可能是
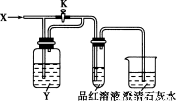
A | B | C | D | |
X | SO2 | C12 | HCl | NO2 |
Y | NaOH溶液 | 饱和NaHCO3溶液 | 饱和NaCl溶液 | Na2SO3溶液 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
某未知溶液可能含Na+、NH4+、Fe2+、I-、Cl-、CO32-、SO32-。将该溶液加少量新制氯水,溶液变黄色。再向上述反应后溶液中加入BaCl2溶液或淀粉溶液,均无明显现象。下列推断合理的是
A.一定存在Fe2+、Na+、Cl- B.一定不存在I-、SO32-
C.一定呈碱性 D.一定存在NH4+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:简答题
(14分)研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。
(1)已知反应:
①2H2(g)+O2(g) 2H2O(g) △H=-483.6 kJ/mol
2H2O(g) △H=-483.6 kJ/mol
②N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
③4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ/mol
4NO(g)+6H2O(g) △H=-905kJ/mol
则反应④4NH3(g)+3O2(g) 2N2(g)+6H2O(g)的△H=___________。
2N2(g)+6H2O(g)的△H=___________。
(2)在恒温恒容的甲容器,恒温恒压的乙容器中分别进行合成氨反应(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。
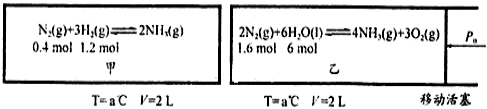
①该条件下甲容器中反应的平衡常数K= ;平衡时,甲容器的压强P = (初始压强用P0表示)。
②该条件下,若向乙中继续加入0.2 mol N2,达到平衡时N2转化率= 。
(3)在实验室中,某同学利用下列试剂及器材完成的实验能够证明NH3·H2O是弱电解质的是_________(选填字母代号)。
A.用氨水做导电性实验,灯泡昏暗
B.将氨水滴入AlCl3溶液中,产生白色沉淀
C.常温下,用pH试纸测得0.1mol/L氨水的pH<13
D.用湿润的蓝色石蕊试纸测得NH4Cl溶液为紫色
(4)常温下,向1molL-1NH4Cl溶液中通入少量的NH3此时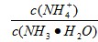 的值 (填“增大”、“减小”或“不变”);若将1molL-1NH4Cl溶液和1molL-1NaOH溶液混合后溶液恰好呈中性,则混合前NH4Cl溶液的体积 NaOH溶液的体积(填“大于”、“小于”或“等于”).
的值 (填“增大”、“减小”或“不变”);若将1molL-1NH4Cl溶液和1molL-1NaOH溶液混合后溶液恰好呈中性,则混合前NH4Cl溶液的体积 NaOH溶液的体积(填“大于”、“小于”或“等于”).
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.H2O在高温下难分解,而H2S在300℃时就分解,说明O非金属性比S强。
B.H2CO3的酸性比HClO的酸性强,所以C的非金属性比Cl强。
C.NaOH的碱性比Mg(OH)2的碱性强, 所以Na的金属性比Mg强。
D.Fe3+的氧化性比Cu2+的氧化性强,但Fe的金属性比Cu强。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三下学期第三次质检考试理综化学试卷(解析版) 题型:选择题
[Fe(CN)6]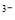 可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]
可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]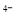 。工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理。下列说法不正确的是
。工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理。下列说法不正确的是
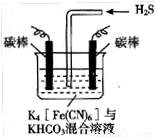
A.电解时阳极反应式为[Fe(CN)6]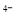 -e
-e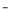
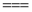 [Fe(CN)6]
[Fe(CN)6]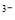
B.电解时阴极反应式为+2 e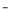
 H2
H2 +2CO
+2CO
C.当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计)
D.整个过程中需要不断补充K4 [Fe(CN)6]与KHCO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省岳阳市高三质量检测(二)理综化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】(15分)已知位于元素周期表前四周期的六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同。请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是____________(填元素符号)
(2)化合物BD3的分子空间构型可描述为_________,B的原子轨道杂化类型为_______。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输。已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物。则F的基态原子价电子排布式为________________。CN-与___________(一种分子)互为等电子体,则1个CN-中π键数目为___________。
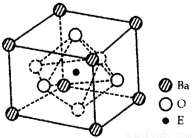
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为__________
在该晶体中,E4+的氧配为数为___________。若该晶胞边长为a nm可计算该晶体的密度为__________g/cm3(阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:填空题
(4分)我国已对酒驾实行了“醉驾入刑”,酒的主要成分是乙醇。请回答下列问题:
(1)乙醇的官能团是 ;
(2)使用K2Cr2O7酸性溶液检测酒驾,利用了乙醇的 (填“氧化性”或“还原性”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:选择题
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和 为24。则下列判断正确的是
| T | |
X | Y | Z |
A.R位于元素周期表中第二周期第VIA族
B.五种元素中原子序数最大的是X
C.气态氢化物稳定性:T>Y
D.Z元素的最高价氧化物对应的水化物的化学式为H2ZO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com