
【题目】镁的化合物在化工生产和药物合成上有重要用途。某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量Fe的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
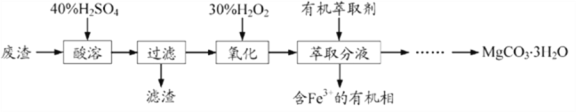
(1)滤渣的成分为________(填化学式),过滤装置在使用一段时间后需用NaOH溶液清洗,用化学方程式表示其清洗原理:____________________________。
(2)加入H2O2的目的是________________________,一段时间后,溶液中有气泡出现并放热,则产生气泡的原因是_______________________________。
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并________。
【答案】H2SiO3 H2SiO3+2NaOH===Na2SiO3+2H2O将Fe2+氧化成Fe3+Fe3+催化H2O2分解检漏
【解析】
废渣主要成分为MgCO3、MgSiO3和少量Fe的氧化物,加入40%的硫酸酸溶,过滤后滤液中含有硫酸镁、硫酸亚铁、过量的硫酸,滤渣为硅酸沉淀,滤液中加入H2O2氧化亚铁离子,然后加入有机萃取剂萃取Fe3+,分液后可除去溶液中的Fe3+,分液后水溶液中含有Mg2+,过滤后在滤液中加入碳酸钠溶液,可生成MgCO3沉淀,干燥后得到MgCO33H2O。以此解答该题。
(1)根据以上分析可知废渣的成分为硅酸,化学式为H2SiO3,硅酸和氢氧化钠反应生成硅酸钠和水,反应的化学方程式为H2SiO3+2NaOH=Na2SiO3+2H2O;
(2)在酸性条件下,H2O2氧化亚铁离子为铁离子,本身被还原为水,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,一段时间后,溶液中有气泡出现并放热是铁离子催化过氧化氢分解生成氧气;
(3)由于分液漏斗有活塞开关,故使用前需要检查是否漏液。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】以下6种为中学化学中常见的物质:①Cu、②NaHSO4、③SO3、④H2SO4、⑤CaCO3、⑥Cu(OH)2;其中属于电解质的是__(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①甲烷、②乙烷、③乙烯、④苯、⑤甲苯、⑥二甲苯、⑦乙醇、⑧乙酸、
⑨葡萄糖,它们都是常见的重要化工原料。
(1)上述物质中,氢元素的质量分数最大的是________(填分子式);
(2)分别写出⑦、⑧中所含官能团的名称__________、___________,
二者发生酯化反应的化学方程式______________________________________,
如果用4.6 g乙醇和9.0 g乙酸充分反应制得乙酸乙酯5.28 g,则本实验的产率是:__________(产率指的是目标生成物的实际产量与理论产量的比值)。
(3)上述物质中,能发生加成反应的烃类物质有:_______________(填序号)。
(4)下列物质中,不能通过乙烯加成反应得到的是____(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
(5)聚氯乙烯,简称PVC,这种材料如果用于食品包装,它对人体的安全性有一定的影响,写出生产聚氯乙烯的化学方程式:__________________________
(6)苯、甲苯、二甲苯是用途广泛的有机溶剂。二甲苯的结构有______种,其中一种被称为“PX”,它的一氯代物只有两种,则“PX”的结构简式是______________。
(7)写出乙醇催化氧化反应的化学方程式 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
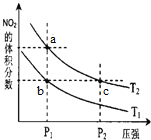
A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,重水(D2O)的离子积为1.6×10-15,也可用pH值一样的定义来规定其酸碱度:pD=-lg[D+],下列有关pD的叙述正确的是( )
①中性D2O的pD=7
②在1LD2O中,溶解0.01molNaOD,其pD值为12
③1L0.01mol/L的DCl的重水溶液,pD=2
④在100mL0.25mol/LDCl的重水溶液中,加入50mL0.2mol/LNaOD的重水溶液,反应后溶液的pD=1.
A. ①②B. ③④C. ②③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用蒸馏水稀释1mol/L的醋酸溶液至0.01mol/L,随溶液的稀释,下列始终保持增大趋势的是( )
A. c(H+)×c(CH3COOH)B. c(CH3COO—)/c(H+)
C. Kw/c(H+)D. c(CH3COOH)/c(CH3COO—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境,必须进行处理。某工厂的处理工艺流程如下:
![]()
(1)N2H4的电子式为___________。
(2)下列溶液中,可以代替上述流程中N2H4的是___________。(填选项序号)
A.FeSO4溶液 B.浓HNO3溶液 C.酸性KMnO4溶液 D.Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为___________。
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬酸性废水中存在着Cr2O72-和CrO42-相互转化的平衡,请用离子方程式表示它们之间的转化反应___________;
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为____________写化学式)。
(5)工业上可用电解法来处理含Cr2O![]() 的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O
的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O![]() 还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。
还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。

①装置中b电极的材料是________(填“铁”或“石墨”)。
②上述处理过程中,Cr2O![]() 被还原成Cr3+的离子方程式为_______________________。
被还原成Cr3+的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型有机酰胺化合物M在工业生产中有重要的应用,其合成路线如下:

已知以下信息:
①A的相对分子质量为58,含氧的质量分数为0.552,已知核磁共振氢谱显示为一组峰,可发生银镜反应。
② ![]()
③R—COOH ![]() R—COCl
R—COCl
④
⑤
请回答下列问题:
(1)A的名称为____________,B中含有官能团名称为_____________。
(2)C→D的反应类型为__________________,生成G的“条件a”指的是___________________。
(3)E的结构简式为___________________。
(4)F+H→M的化学方程式为____________________________。
(5)芳香族化合物W有三个取代基,与C互为同分异构体,当W分别与Na、NaOH充分反应时,1mol W最多可消耗的Na、NaOH分别为2 mol、1mol。试分析W共有________种同分异构体,每一种同分异构体的核磁共振氢谱中有____________组峰。
(6)参照上述合成路线,以C2H4和HOCH2CH2OH为原料(无机试剂任选),设计制备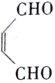 的合成路线___________________。
的合成路线___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:

已知:①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量FeO、MgO等。
②Li2O·Al2O3·4SiO2+H2SO4![]() Li2SO4+Al2O3·4SiO2·H2O
Li2SO4+Al2O3·4SiO2·H2O
③某些物质的溶解度(S)如下表所示。
T℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
④Fe3+完全沉淀时pH为3.4
(1)为提高原料浸出速率,除升高温度外还可采取的措施是__________(任写一条)。
(2)在滤液1中加入H2O2的目的是__________(用离子方程式表示);调节pH最佳试剂是__________(填序号 )。
A.CuO B.CuCO3 C.MgO D.NH3·H2O
(3)从滤渣中分离出Al2O3的流程如下图所示,请写出生成沉淀的离子方程式__________。
![]()
(4)向滤液2中加入Na2CO3溶液的作用是__________。
(5)“过滤、热水洗涤”步骤中,“热水洗涤”的原因是__________;证明沉淀已洗净的操作是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com