
 近年来,化学工作者在CO2的应用研究上取得了一些重要成果.
近年来,化学工作者在CO2的应用研究上取得了一些重要成果.| 3 |
| 2 |
| ||
| 3 |
| 2 |
| ||
| 1-y |
| 3 |
| 4(1-y) |
| 3 |


科目:高中化学 来源: 题型:
| A、①③⑤ | B、②③④ |
| C、①③④ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
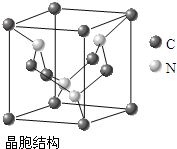 [化学-物质结构与性质]
[化学-物质结构与性质]| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 维生素C是人体维持正常生命过程所必需的一种物质,主要来源于新鲜的蔬菜和水果中,其结构如图.下列关于维生素C的说法中正确的是( )
维生素C是人体维持正常生命过程所必需的一种物质,主要来源于新鲜的蔬菜和水果中,其结构如图.下列关于维生素C的说法中正确的是( )| A、能使FeCl3溶液显紫色 |
| B、难溶于水,易溶于有机溶剂 |
| C、能使溴的四氯化碳溶液褪色 |
| D、能发生加成反应和氧化反应,但不能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com