
| A. | 1 mol/LNaHCO3溶液与1 mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | pH=x的氨水溶液,稀释10倍后,其pH=y,则x=y+1 | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中显酸性 | |
| D. | pH相同的①CH3COONa;②NaHCO3;③NaC1O三种溶液的c(Na+):①>②>③ |
分析 A.恰好反应达到碳酸钠溶液,溶液中CO32-离子水解,溶液呈碱性,溶液中氢氧根离子源于水的电离、碳酸根的水解;
B.一水合氨为弱电解质,稀释10倍后,pH减小小于1;
C.一水合氨为弱电解质,pH=12的氨水的浓度远远大于0.01mol/L,等体积混合达到氯化铵、与氨水混合溶液,且一水合氨的浓度远大于氯化铵的浓度;
D.酸性越强,酸根离子水解程度越弱.
解答 解:A.恰好反应达到碳酸钠溶液,溶液中CO32-离子水解,溶液呈碱性,溶液中氢氧根离子源于水的电离、碳酸根的水解,则溶液中c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故A错误;
B.一水合氨为弱电解质,稀释10倍后,pH减小小于1,稀释后pH=y,则x<y+1,故B错误;
C.一水合氨为弱电解质,pH=12的氨水的浓度远远大于0.01mol/L,等体积混合达到氯化铵、与氨水混合溶液,且一水合氨的浓度远大于氯化铵的浓度,一水合氨的到来程度大于铵根离子水解程度,溶液呈碱性,故C错误;
D.酸性醋酸>碳酸>HClO,故水解程度NaC1O>NaHCO3>CH3COONa,pH相同的三种溶液的浓度:NaC1O<NaHCO3<CH3COONa,则反应中c(Na+):CH3COONa>NaHCO3>NaClO,故D正确.
故选:D.
点评 本题考查离子浓度大小比较、弱电解质电离、盐类水解、溶液酸碱性定性判断等,掌握离子浓度大小比较方法,有利于培养学生的分析能力、知识迁移运用.


科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得到均匀的紫色溶液 | B. | 无色水层下有橙红色液体 | ||
| C. | 无色水层下有紫色油状液体 | D. | 无色水层上有紫色油状液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
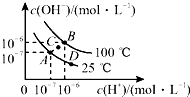
| A. | 图中A、B、D三点处Kw的大小关系:B>A>D | |
| B. | 若处在B点,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显中性 | |
| C. | 25℃时,保持温度不变,在水中加入适量NH4Cl固体,体系可从A点变化到C点 | |
| D. | A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精溶于水 | B. | HCl溶于水得盐酸 | ||
| C. | 将Na2SO4熔融呈液态 | D. | 从NH4HCO3中闻到了刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核裂变是一种化学变化 | |
| B. | 12753I的质量数为127,原子序数为53,核内有74个中子 | |
| C. | 碘12753I和放射性碘13153I属于同素异形体 | |
| D. | 12753I与13153I是同一种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
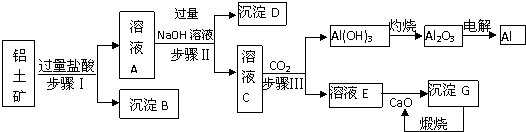
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com