
科目:高中化学 来源:2016-2017学年辽宁省北校高一3月月考化学试卷(解析版) 题型:选择题
现有下列短周期元素性质的数据:下列关于表中11种元素的说法正确的是
元素 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ |
原子半径 (10-10m) | - | 0.37 | 0.74 | 0.75 | 0.77 | 0.82 | 0.99 | 1.10 | 1.52 | 1.60 | 1.86 |
最高或最低化合价 | 0 | +1 | +5 | +4 | +3 | +7 | +5 | +1 | +2 | +1 | |
-2 | -3 | -4 | -1 | -3 |
A. 上表中11种元素中形成的非金属单质都有非极性共价键
B. ②⑨处于同一周期,④⑧处于同一主族
C. 上表中11种元素中最高价氧化物对应的水化物中⑦号酸性最强
D. ⑥原子结构示意图为: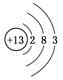
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的特征电子构型为3d64S2;Z原子的L电子层的p能级上有一介空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是
A. 元素Y和Q可形成化合物Y2Q3
B. X与T的最高价氧化物对应的水化物,前者的酸性比后者强
C. X和Q结合生成的化合物为离子化合物
D. ZQ2是极性键构成的直线形分子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
利用下列实验装置进行相应的实验,能达到实验目的的是
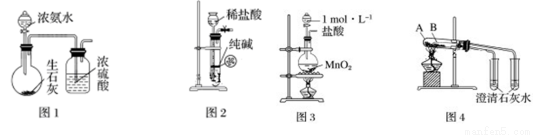
A.用图1所示装置制取干燥的氨气
B.图2装置可用于制取少量纯净的CO2气体
C.用图3所示装置制取少量Cl2
D.图4装置可用于比较碳酸钠和碳酸氢钠的热稳定性,大试管A中装碳酸钠固体,小试管B中装碳酸氢钠固体
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:实验题
直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。
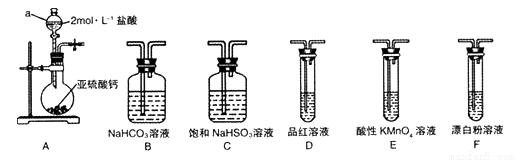
(1)装置A中仪器a的名称为__________。若利用装置A中产生的气体证明+4价的硫元素具有氧化性,试用化学方程式表示该实验方案的反应原理________________。
(2)选用图4中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是_________________。
②丙同学设计的合理实验方案为:按照A→C→_________→F→尾气处理(填字母) 顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是_____________________。
③其中装置C的作用是__________。常温下,测得装置C中饱和NaHSO3溶液的pH≈5,则该溶液中所有离子的浓度由大到小的顺序为__________________。(已知0.1mol/L的H2SO3溶液pH >1)
(3)为了测定装置A残液中SO2的含量,量取10.00 mL残液于圆底烧瓶中,加热使SO2 全部蒸出,用20.00 mL0.0500 mol/L的KMnO4溶液吸收。充分反应后,再用0.2000mol/L的KI标准溶液滴定过量的KMnO4 ,消耗KI溶液15.00 mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①残液中SO2的含量为_______g·L-1。
②若滴定过程中不慎将KI标准溶液滴出锥形瓶外少许,使测定结果_______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一下学期第一次月考化学试卷(解析版) 题型:填空题
四种短周期元素在周期表中的相对位置如下图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
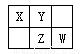
请回答下列问题:
(1)元素Z位于周期表中的位置_____________________。
(2)X、Y、Z三种元素的最高价氧化对应水化物中酸性由强到弱依次为________________(写化学式)。
(3)X和Y形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,该化合物的分子式为__________,该分子中各原子最外层均满足8电子稳定结构,其结构式为 ___________.
(4)写出W的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式_____________,
反应中若转移12mol电子,消耗的还原剂质量为______g。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期.下列有关推测正确的是( )
A. XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B. XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C. XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D. XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3
查看答案和解析>>
科目:高中化学 来源:四川省广安、遂宁、内江、眉山四市2017届高三第二次诊断考试理综化学试卷 题型:填空题
CO2是温室气体,研究CO2的应用对促进低碳生活具有重要意义。
(1)1922年德国工业化生产尿素
Ⅰ:2NH3(g)+CO2(g)  NH2COONH4(s) ΔH1=-159.50kJ·mol-1
NH2COONH4(s) ΔH1=-159.50kJ·mol-1
Ⅱ:NH3COONH4(s)  CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
①写出用NH3和CO2合成尿素总反应的热化学方程式_________;按照酸碱质子理论,能接受H+的物质为碱,现常温下溶液中存在反应:NH3+NH2COOH NH2COONH4(K=1×1010),则该溶液中碱性强弱为:NH3____NH2COONH4(填“强于”、“弱于”、“相等”或“不能确定”)。
NH2COONH4(K=1×1010),则该溶液中碱性强弱为:NH3____NH2COONH4(填“强于”、“弱于”、“相等”或“不能确定”)。
②在一个体积恒为1L的恒温密闭容器中充入2molCO2和4molNH3的混合气体,经历反应Ⅰ、Ⅱ合成CO(NH2)2,混合气体中的氨气体积分数及气体总浓度随时间变化如下图所示。

对于反应Ⅰ:A点的正反应速率与B点的逆反应速率的大小关系是:v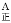 _______v
_______v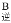 (填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
(填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
对于反应Ⅱ:从动力学分析,选用合适正催化剂可以使该反应活化能_______(“增大”“减小”或“不变”)
(2)利用二氧化碳制备乙烯
用惰性电极电解强酸性二氧化碳水溶液可得到乙烯,其原理如下图所示。
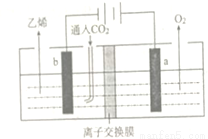
①b电极上的电极反应式为______________;
②该装置中使用的是___________(填“阴” 或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:选择题
根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,2min后,试管里出现凝胶 | 非金属性:Cl>Si |
B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液,溶液由红色变为黄色 | KCl溶液具有碱性 |
C | 在CuSO4溶液中滴加KI溶液,再加入苯,振荡,有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
D | 某溶液滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中可能不含SO42- |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com